
【题目】(1)下面是我们熟悉的物质:
①O2②SO2③CaCl2④HNO3⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
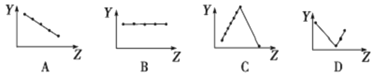
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____________。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,
它们之间存在如图中转化关系。
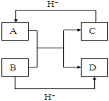
请写出:A的化学式 (写一种);D的化学式 。
【答案】(1) ②④ ;③⑤⑥ ;③;(2)①B;②E;③G;
(3)①原子;②K+ ;(4)HF(或NH4+);H2O。
【解析】试题分析:(1)共价化合物一般指非金属氧化物、酸等,因此②、④属于共价化合物;离子化合物一般包括金属氧化物、碱、盐等,属于离子化合物的是③⑤⑥;离子化合物含有离子键,只含离子键的是③;(2)①同主族最外层电子数相等,即B正确;②电子层数越多,半径越大,电子层数相等,半径随着原子序数的递增而减小,P3->S2->Cl->Na+>Mg2+>Al3+,故E正确;③同周期,从左向右半径减小,故G正确;(3)①x=2+8+y,即x-y=10,因此属于原子;②得到一个电子变为原子,核外有4个电子层,最外层1个电子,因此属于K;(4) HF(或NH4+);H2O。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种有机物 ①乙烯、②乙醇、③淀粉中,可从石油中获得的化工原料是_______(填序号,下同),可用于生产葡萄糖的是______,可用作溶剂的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
B.FeSO4溶液中加入酸性H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O
C.Cl2和水反应:Cl2+H2O=2H++Cl-+ClO-
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2![]() I2+2H2O
I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示。下列有关的说法错误的是( )
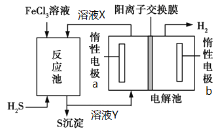
A. 惰性电极a发生氧化反应
B. Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解
C. 溶液Y加热蒸发灼烧最终得到Fe2O3
D. 电解池总反应的离子方程式为2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用试纸检验气体性质是一种重要的实验方法。如图所示的实验(可加热)中,下列试剂的选用、现象、对应结论都正确的一项是( )
选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
A | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
D | Cu,浓硝酸 | 淀粉KI试纸 | 变蓝 | NO2为酸性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
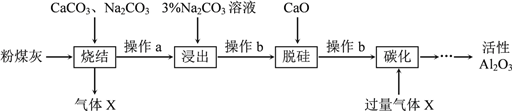
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式_________________________。
(2)操作a为冷却、研磨,其中研磨的目的是________________________。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为_______________。
(4)操作b的名称是_________,所用的玻璃仪器有___________、__________和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为________________。
(6)上述过程中循环使用的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
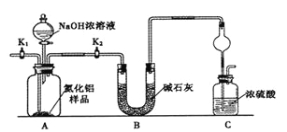
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
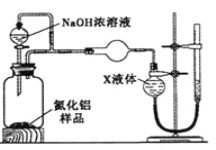
(4)为测定生成气体的体积,量气装置中的X液体可以是 。
a.CCl4 b.H2O
c.NH4Cl溶液 d.苯
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数是 。
【方案3】按以下步骤测定样品中A1N的纯度:
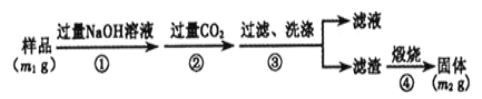
(6)步骤②生成沉淀的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42﹣从右向左移动.下列分析正确的是( )
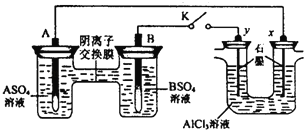
A.溶液中c(A2+)浓度减小
B.B的电极反应:B﹣2e﹣═B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com