
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、0.25 mol?L-1 |
| V |
| Vm |
| n |
| V |
| 1.12L |
| 22.4L/mol |
| 0.2mol |
| 0.1L |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)下列说法正确的是( )| A、该温度下,Ksp(BaSO4)=1.0×10-24 |
| B、a点的Ksp(BaSO4)小于b点的Ksp(BaSO4) |
| C、d点表示的是该温度下BaSO4的不饱和溶液 |
| D、加入BaCl2可以使溶液由c点变到a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化铝锂溶于水后溶液呈中性 |
| B、氢化铝锂与水反应的过程中,氢化铝锂中的氢被还原成氢气 |
| C、氢化铝锂中各微粒的半径大小关系为Al3+>H->Li+ |
| D、氢化铝锂与水反应的过程中,氢化铝锂表现出强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
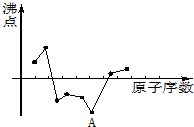
| A、C | B、Na | C、Ne | D、N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、67.6% |
| B、83.2% |
| C、88.2% |
| D、91.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g H2O中含的质子数为10NA |
| B、标准状况下,11.2L SO3中所含分子数目为0.5NA |
| C、46g NO2和N2O4混合气体中含有原子总数为3NA |
| D、132g硫酸铵中含有氮原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化产物与还原产物的物质的量之比为2:1 |
| B、铁粉剩余,溶液呈浅绿色,Cl-基本不变 |
| C、向溶液中滴入无色KSCN溶液,仍无色 |
| D、Fe2+和Fe3+物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com