

| A����ʼʱn��H2��Ϊ1��7mol |
| B����������ѹǿ�㶨ʱ��˵����Ӧ�ﵽƽ��״̬ |
| C��4����ʱ���ı�������������¶� |
| D��7����ʱ��v��CO��=v��CH3OH�� |

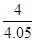 ����
����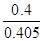 �� ��1�֣���λ����Ҫ��
�� ��1�֣���λ����Ҫ��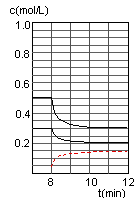
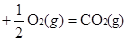 ��H1����283.0kJ��mol
��H1����283.0kJ��mol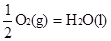 ��H2����285.8 kJ/mol
��H2����285.8 kJ/mol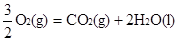 ��H3����726.5kJ/mol
��H3����726.5kJ/mol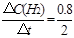 ="0.4" mol��L-1��min-1
="0.4" mol��L-1��min-1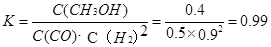



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2 molH2(g)��1molO2(g)����������2mol H2O (l)������ |
| B��1 mol H2O (g)�ֽ��H2(g)��O2 (g)������241.8kJ���� |
| C��1mol H2O (l)���1mo1 H2O (g)������88 kJ���� |
| D����������H2O (g)��H2O(l������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2Fe��s��+3CO2��g�� ��H= ��28��5 kJ����mol��1
2Fe��s��+3CO2��g�� ��H= ��28��5 kJ����mol��1 2CO��g�� ��H=" +" 172��5 kJ��mol��1
2CO��g�� ��H=" +" 172��5 kJ��mol��1 2Fe��s��+3CO��g�� ��H= kJ��mol��1
2Fe��s��+3CO��g�� ��H= kJ��mol��1 2Fe��s��+3CO2��g�� ��H=��28��5 kJ��mol��1��ƽ�ⳣ������ʽK= ���¶Ƚ��ͺ�Kֵ ��������������䡱��С������
2Fe��s��+3CO2��g�� ��H=��28��5 kJ��mol��1��ƽ�ⳣ������ʽK= ���¶Ƚ��ͺ�Kֵ ��������������䡱��С������| | Fe2 O3 | CO | Fe | CO2 |
| ������ | 1��0 mol | 1��0 mol | 1��0 mol | 1��0 mol |
| ������ | 1��0 mol | 2��0 mol | 1��0 mol | 1��0 mol |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2Fe��s��+3CO2��g������ش��������⣺
2Fe��s��+3CO2��g������ش��������⣺| A���ܱ���������ѹǿ���� |
| B���ܱ������л�������ƽ��Ħ���������� |
| C���ܱ������л��������ܶȲ��� |
| D��c��CO��= c��CO2�� |
 2Fe3O4��s��+CO2��g�� ��H="�C47" kJ/mol
2Fe3O4��s��+CO2��g�� ��H="�C47" kJ/mol 3FeO��s��+CO2��g�� ��H=" +19" kJ/mol
3FeO��s��+CO2��g�� ��H=" +19" kJ/mol Fe��s��+CO2��g�� ��H="�C11" kJ/mol
Fe��s��+CO2��g�� ��H="�C11" kJ/mol 2Fe��s��+3CO2��g���ġ�H= ��
2Fe��s��+3CO2��g���ġ�H= ��| �¶� | 250�� �� 600�� �� 1000�� �� 2000�� |
| ��Ҫ�ɷ� | Fe2O3 Fe3O4 FeO Fe |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1
CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1 CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1
CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1 CH3CH2OH(g) +3H2O(g) ��H = ��
CH3CH2OH(g) +3H2O(g) ��H = ��
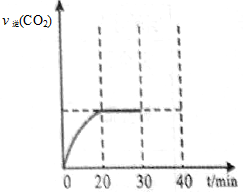
 N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�| �� Ũ��/mol?L��1 ʱ��/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


| A�������¶� | B������ѹǿ |
| C������H2O��g����Ũ�� | D������CO2��g����Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2��1 mol CO 1 mol NO��1 mol CO2 |
| ƽ��ʱc(NO) /mol��L-1 | 1.5 | 3 | m |
| �����仯 | �ų�a kJ | ����b kJ | �ų�c kJ |
| CO��NO��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Si3N4(s) + 12 HCl(g) ��H��0
Si3N4(s) + 12 HCl(g) ��H��0  O2(g)=== CO(g) ��H2 ����110 kJ��mol��1
O2(g)=== CO(g) ��H2 ����110 kJ��mol��1�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com