
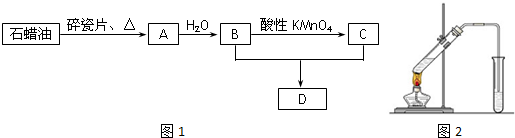
分析 A产量可以衡量一个国家石油化工水平的高低,则A应为CH2=CH2,石蜡油发生裂化得到乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成C为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成D为乙酸乙酯,
(1)工业上,由石油分馏获得石蜡油,由石蜡油通过减压分馏获得乙烯,也称为裂化;
(2)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应B+C→D是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯;
(3)使乙烯与氯气发生完全加成反应生成1,2-二氯乙烷,然后与氯气在光照的条件下发生完全取代反应;
(4)实验室制备乙酸乙酯,用饱和碳酸钠溶液除去产物中的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于溶液分层;
(5)反应为可逆反应,乙酸和乙醇容易挥发,温度过高乙醇发生反应生成乙醚或者乙烯.
解答 解:A产量可以衡量一个国家石油化工水平的高低,则A应为CH2=CH2,石蜡油发生裂化得到乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇被酸性高锰酸钾氧化生成C为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成D为乙酸乙酯,
(1)工业上,由石油分馏获得石蜡油,由石蜡油获得乙烯属于裂化,是化学变化,
故答案为:减压分馏;裂解;
(2)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$ CH3-CH2OH,
反应B+C→D是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式是:CH2COOH+CH3CH2OH $\stackrel{一定条件下}{→}$ CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$ CH3-CH2OH;加成反应;CH2COOH+CH3CH2OH $\stackrel{一定条件下}{→}$ CH3COOCH2CH3+H2O;取代反应(或酯化反应);
(3)使1mol乙烯与氯气发生完全加成反应,消耗1mol氯气,反应生成1,2-二氯乙烷,然后与氯气在光照的条件下发生完全取代反应,消耗4mol氯气,则两个过程中消耗氯气的总物质的量是5mol,
故答案为:5;
(4)实验室制备乙酸乙酯,收集产物的试管中盛放的液体为:饱和碳酸钠溶液,该溶液可以除去产物中的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于溶液分层,
故答案为:饱和碳酸钠溶液;乙酸;乙醇;降低乙酸乙酯在水中的溶解度,便于溶液分层;
(5)由于酯化反应是可逆的过程,反应物不可能完全反应;原料来不及反应就被蒸出、温度过高发生了副反应等,都使加入的乙酸和乙醇的量要比理论计算量多得多,
故答案为:原料来不及反应就被蒸出;温度过高发生了副反应.
点评 本题考查了石蜡油分解制取乙烯及乙烯的化学性质、乙酸乙酯的制取等知识,题目难度中等,注意掌握乙烯的工业制法及化学性质,明确乙酸乙酯的制取原理.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| C. | 100 mL 0.2 mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥ | B. | ①③④⑦⑧ | C. | ③④⑤⑥⑦ | D. | ①②④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入溴水,溴水褪色 | |
| B. | 将SO2气体通入滴入有酚酞的NaOH溶液中,红色褪色 | |
| C. | 将SO2通入品红溶液中,品红溶液褪色 | |
| D. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com