
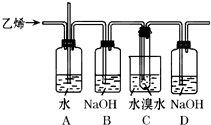
 已知1,2-二溴乙烷的主要物理性质如表:
已知1,2-二溴乙烷的主要物理性质如表:| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79°C | 131.4°C | 2.18g/cm3 | 难溶于水,易溶于醇、醚等 |
| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
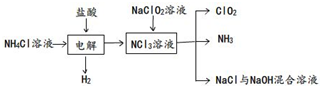
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
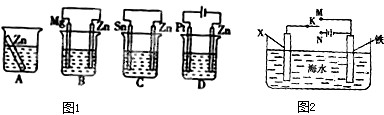
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
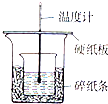 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
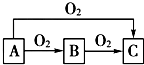 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条 件及产物略去):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰熔化时,分子中H-O键发生断裂 |
| B、HI比HF易分解,是因为HI分子间不存在氢键 |
| C、CO2与SiO2都属于分子晶体 |
| D、熔沸点由高到低的顺序是:金刚石>NaCl>Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com