

 ;
; ;
; 、
、 .
. 分析 苯与浓硝酸在浓硫酸、加热条件下发生硝化反应生成A为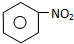 ,与溴发生取代反应,由信息可知,取代硝基间位氢原子生成B为
,与溴发生取代反应,由信息可知,取代硝基间位氢原子生成B为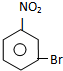 .苯与溴在催化剂条件下发生取代反应生成溴苯,由信息可知,溴苯与浓硝酸、浓硫酸条件下发生取代反应,硝基取代溴原子邻位或对位位置氢原子,故C为
.苯与溴在催化剂条件下发生取代反应生成溴苯,由信息可知,溴苯与浓硝酸、浓硫酸条件下发生取代反应,硝基取代溴原子邻位或对位位置氢原子,故C为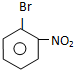 ,C与溴发生取代反应,取代溴原子邻位或对位位置,故生成D、E为
,C与溴发生取代反应,取代溴原子邻位或对位位置,故生成D、E为 、
、 .
.
解答 解:苯与浓硝酸在浓硫酸、加热条件下发生硝化反应生成A为 ,与溴发生取代反应,由信息可知,取代硝基间位氢原子生成B为
,与溴发生取代反应,由信息可知,取代硝基间位氢原子生成B为 .苯与溴在催化剂条件下发生取代反应生成溴苯,由信息可知,溴苯与浓硝酸、浓硫酸条件下发生取代反应,硝基取代溴原子邻位或对位位置氢原子,故C为
.苯与溴在催化剂条件下发生取代反应生成溴苯,由信息可知,溴苯与浓硝酸、浓硫酸条件下发生取代反应,硝基取代溴原子邻位或对位位置氢原子,故C为 ,C与溴发生取代反应,取代溴原子邻位或对位位置,故生成D、E为
,C与溴发生取代反应,取代溴原子邻位或对位位置,故生成D、E为 、
、 ,
,
(1)反应②的化学方程式是: ,反应④的化学方程式为
,反应④的化学方程式为 等,
等,
故答案为: ;
; 等;
等;
(2)由上述分析可知,D、E为 、
、 ,
,
故答案为: 、
、 .
.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,注意把握题中取代反应的重要信息,较好的考查学生的自学能力,注意积累基础知识,以及知识的综合利用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | V${\;}_{{A}_{2}}$=0.4mol•L-1min-1 | B. | v${\;}_{{B}_{2}}$=0.8 mol•L-1min-1 | ||
| C. | vAB3=0.6mol•L-1min-1 | D. | v${\;}_{{A}_{2}}$=0.01 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na被氧化完全转化生成Na2O2,失去电子数为2NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将lmL 1 mol•L-1FeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA | |
| D. | 标准状况下,6.72L NO2与足量水充分反应转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | |
| C. | 往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 含等物质的量浓度的CH3COOH和CH3COONa混合溶液中:2c(H+)-c(CH3COO-)=2c(OH-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②⑥ | C. | ③④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1 mol H-H的同时断开2 mol N-H | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24 L己烷中,分子数为0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl键数为NA | |
| C. | 常温常压下16 g O2和O3混合气体中,氧原子数为NA | |
| D. | 7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com