
| A. | 1 mol HCl所具有的总能量高于1 mol H2所具有的总能量 | |
| B. | 1 mol H2和1 mol Cl2所具有的总能量高于2 mol HCl所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
分析 A.该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量;
B.反应物总能量大于生成物总能量为放热反应;
C.根据放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
D.氢气在氯气中燃烧发出苍白色的火焰,放出大量的热.
解答 解:A.该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量,而1 mol HCl与1 mol H2所具有的能量无法比较,故A错误;
B.氢气燃烧为放热反应,反应物总能量大于生成物总能量,则1 mol H2和1 mol Cl2所具有的总能量高于2 mol HCl所具有的总能量,故B正确;
C.反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl为放热反应,断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量,故C错误;
D.氢气在氯气中燃烧发出苍白色的火焰,放出大量的热,该反应中化学能转变为热能和光能,故D错误;
故选:B.
点评 本题主要考查了化学反应的本质以及能量变化原因,明确反应热效应与物质的能量、化学键的变化是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
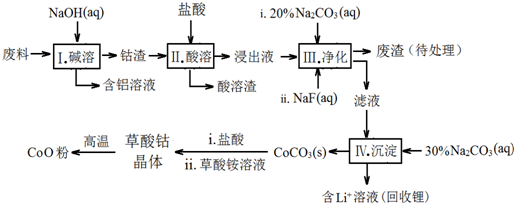
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
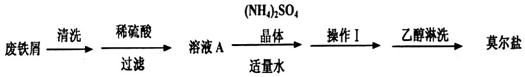
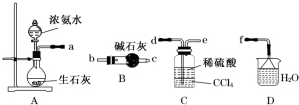
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A2和B2的总能量之和大于生成的AB的总能量,则反应吸热 | |
| B. | 若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
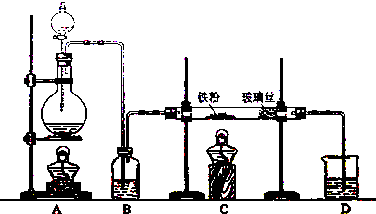
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的Cu2+、Ag+、H+的溶液中加入铁粉直至过量:Cu2+、Ag+、H+ | |
| B. | 在含Al3+、H+、NH4+的溶液中逐渐加入过量烧碱溶液:H+、NH4+、Al3+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2至过量:KOH、Ba(OH)2 | |
| D. | 在含I-、Br-、Fe2+的溶液中通入过量Cl2:I-、Fe2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).请用化学方程式表示合成过程.
).请用化学方程式表示合成过程.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com