
| A. | 氢氧化钠固体 | B. | 浓盐酸 | C. | 铜 | D. | 蔗糖 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石、碳化硅、晶体硅的熔点依次升高 | |
| B. | CO2和SiO2 化学式相似,物理性质也相似 | |
| C. | CH3CH(CH2OH)CH2OOCCH3是一种手性分子,水解后手性消失 | |
| D. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | 放热 1940 kJ | B. | 吸热 1940 kJ | C. | 放热 485 kJ | D. | 吸热 485 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入氯化亚铁溶液可制取氢氧化铁胶体 | |
| B. | 镁带燃烧可以用二氧化碳灭火器扑灭 | |
| C. | 铁能从硫酸铜溶液中置换出铜,生成硫酸铁 | |
| D. | 硅酸的酸酐是二氧化硅,能溶于氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeBr2与1molCl2反应时转移的电子数为1NA | |
| B. | 10g H218O与D216O的混合物中所含中子、电子数目均为5NA | |
| C. | 标况下,22.4L甲烷中含有C-H键数为1NA | |
| D. | pH=2的H2SO4溶液1L,含H+的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
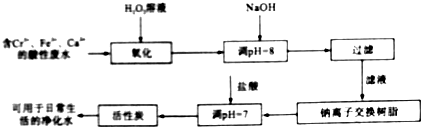
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com