
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:解答题
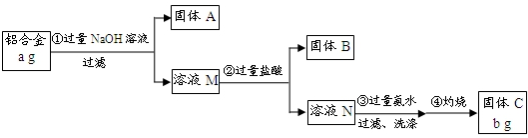
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做过碘升华实验的烧杯用酒精洗涤 | |
| B. | 做过银镜反应实验的试管用稀硝酸洗涤 | |
| C. | 将汽油放在带橡皮塞的玻璃瓶中 | |
| D. | 往双氧水中滴入几滴三氯化铁溶液加快分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、NO3-、H+ | B. | K+、Cu2+、NO3-、H+ | ||
| C. | H+、Na+、NO3-、HCO3- | D. | NH4+、Fe2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
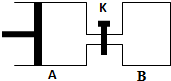 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用物质A表示的反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示的反应速率为0.6 mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl (SO4)2=K++Al3++2 SO42- | B. | H2CO3=H++HCO3- | ||
| C. | Ca(HCO3)2=Ca2++2H++2CO32- | D. | Ba(OH)2=Ba2++OH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com