
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图1的装置:
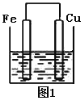
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为__________mol;
(4)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
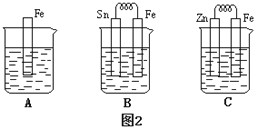
①图2 B中的Sn为________极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)____。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(5)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
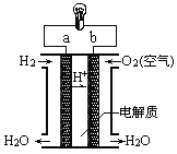
①氢氧燃料电池的正极电极反应是:___________________。电池工作一段时间后硫酸溶液的浓度_____________(填“增大”“减小”或“不变”)。
【答案】![]() 溶液颜色变浅 0.02 正 增大 锌
溶液颜色变浅 0.02 正 增大 锌 ![]()
![]() 减小
减小
【解析】
(1)铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为![]() ,铜为正极,发生还原反应,电极方程式为
,铜为正极,发生还原反应,电极方程式为![]() ,则铜片周围溶液会出现溶液颜色变浅的现象;
,则铜片周围溶液会出现溶液颜色变浅的现象;
(2)设转移xmol电子,则消耗![]() ,析出
,析出![]() ,则有
,则有![]() ,
,![]() ;
;
(3)①B装置构成原电池,Fe更活泼易失电子作负极,Sn作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为![]() ↑,导致氢离子浓度降低,溶液的pH增大
↑,导致氢离子浓度降低,溶液的pH增大
②A装置中Fe发生化学腐蚀;装置B、C构成原电池,B装置中Fe更活泼易失电子作负极,Sn作正极;C装置中Zn易失电子作负极,Fe作正极,作负极的金属加速被腐蚀,所以锌被腐蚀,作正极的金属铁被保护,金属腐蚀快慢速率为:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为![]() ;
;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水,其反应的总方程式为:![]() ;
;
②已知氢氧燃料电池的总反应为:![]() ,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小。
,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】将2.5g NaOH、NaHCO3、Na2CO3固体粉末溶于水,制成溶液,然后逐渐向其中滴加1mol/L的盐酸,所加入盐酸的体积与产生的CO2的体积(标准状况)的关系如图像所示:
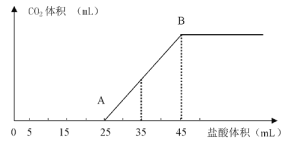
(1)写出OA段发生的离子反应方程式___________________、___________________________
(2)当加入35mL盐酸时,产生CO2的体积为_________________(标准状况)
(3)原混合物中NaOH的质量为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮元素及其化合物与人类的生产生活密切相关,试回答下列有关问题:
(1)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1molL-1的氨水,溶液中随着水量的增加而减小的是___________(填序号)。
A.![]() B.
B.![]() C.c(H+)c(OH-) D.
C.c(H+)c(OH-) D.![]()
(2)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是______________(用离子方程式表示)。向该溶液中滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L-1。(NH3·H2O的电离平衡常数为Kb=2×10-5)
(3)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为_______________________。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被誉为21世纪的“终极能源”,具有高效、高压、环保、体积小等特点,氢能转化被视为新能源汽车终极解决方案,也是资本与技术趋之若鹜的领域。镧镍合金LaNix是一种良好的储氢材料。工业上可用下列方法冶炼镍。
![]()
(1)一个电子的运动状态取决于________种因素,基态Ni原子核外电子占据_____个不同原子轨道。
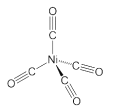
(2)CO分子内σ键和π键个数之比为________;已知Ni(CO)4的结构如图所示,中心原子Ni的杂化类型为_________,Ni原子参与形成了______个配位键,Ni(CO)4属于______晶体,理由是________________________________。
(3)研究发现镧镍合金LaNix属六方晶系,其晶胞如图a中实线或图a所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_______;
②晶胞中和“![]() ”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______________g/cm-3(保留2位有效数字,NA=6.0×1023![]() =1.7)。
=1.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
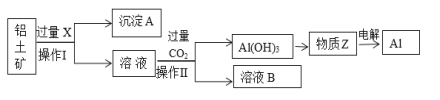
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:____________。
(3)沉淀A的主要成分是________,溶液B中的成分为:_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com