
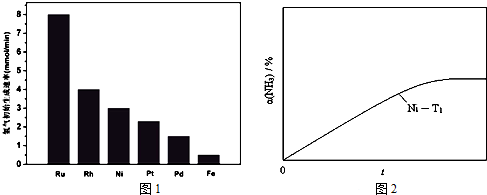
 ,故答案为:
,故答案为: ;
; ,
, [总趋势曲线(标注Ru-T2)];
[总趋势曲线(标注Ru-T2)];| c(N2)×c3(H2) |
| c2(NH3) |
| 0.2c0×(0.6c0)3 |
| (0.6c0)2 |


科目:高中化学 来源: 题型:
| A、+2 | B、+3 | C、+4 | D、+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、金刚石和石墨的熔点肯定要比C60高 |
| B、据估计C60熔点比金刚石和石墨要高 |
| C、无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 |
| D、球碳分子是碳的同素异形体,而管状碳分子、洋葱状碳分子则不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C8H18(l)+
| ||
B、C8H18(l)+
| ||
C、C8H18(l)+
| ||
D、C8H18(l)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 的分子式为
的分子式为 分子中,处于同一平面上的原子数最多可能有
分子中,处于同一平面上的原子数最多可能有 的单体为
的单体为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cl-、Na+、SiO32- | ||
B、Ba2+、NO
| ||
| C、K+、Na+、I-、SO42- | ||
D、Na+、Cu2+、NH3.H2O、SO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com