
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
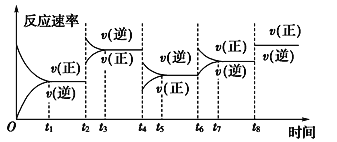
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“接触法制硫酸”的主要反应是2SO2+O2![]() 2SO3在催化剂表面的反应历程如下:
2SO3在催化剂表面的反应历程如下:
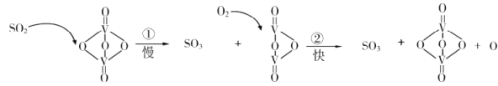
下列说法正确的是
A.使用催化剂只能加快正反应速率B.反应②的活化能比反应①大
C.该反应的催化剂是V2O4D.过程中既有V—O键的断裂,又有V—O键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将200mlBaCl2溶液等分为两份,一份中加入100ml物质的量浓度为0.1mol/L的稀硫酸,恰好完全沉淀;另一份中加入足量AgNO3溶液,使其充分沉淀。试计算:
(1)此BaCl2溶液的物质的量浓度是________
(2)上述反应中生成的AgCl沉淀的质量是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.5mol/L的硫酸溶液500mL。根据溶液的配制情况回答下列问题。
(1)根据计算得知,需量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为________mL。
(2)在如图所示仪器中,配制上述溶液肯定不需要的有_________(填序号)
A.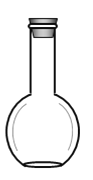 B.
B.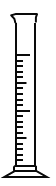 C.
C.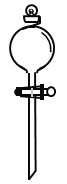 D.
D.![]()
(3)实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.量取所需浓硫酸 ,在烧杯中用适量的蒸馏水将它稀释并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为_______(填序号)。
(4)下列情况中,会使所配溶液浓度偏高的是_______(填序号)。
A.量取所需浓硫酸某同学观察液面时仰视
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,洗涤的液体注入容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。
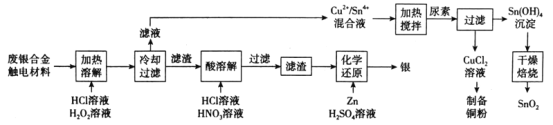
回答下列问题:
(1)“加热溶解”时Cu发生的离子方程式为_________。
(2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为_________。
(3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为_____________。
(4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为__________。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)检验Sn(OH)4沉淀是否洗涤干净的方法是____________。
(6)用惰性电极电解CuCl2溶液,阴极反应式是___________,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在工业生产中有着广泛的应用,可作为制硫酸的催化剂,从含钒废料(含有V2O5、V2O4、SiO2、Fe2O3等)中回收V2O5的流程如下:
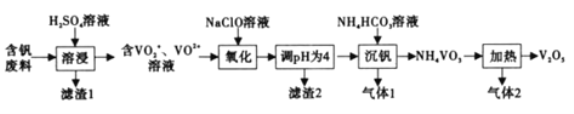
巳知:NH4VO3微溶于冷水,易溶于热水,不溶于乙醇。
回答下列问题:
(1)为提高浸出速率,除适当増加硫酸浓度外,还可采取的措施有______(写出一条),滤渣1的成分是_____________,酸浸时V2O4发生反应的离子方程式为_______________。
(2)“氧化反应”反应中还原剂与氧化剂的物质的量之比为______。
(3)该流程中可循环利用的物质有______(填化学式)。
(4)已知![]() +2H+
+2H+![]()
![]() +H2O,沉钒”过程中,主要反应的离子方程式为______。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________。
+H2O,沉钒”过程中,主要反应的离子方程式为______。沉钒后为了得到尽可能多的NH4VO3,需要进行的主要操作有:冷却过滤、___________。
(5)钒电池是目前发展势头强劲的优秀绿色环保电池,全钒液流储能电池就是其中一种,它的正负极活性物质形成的电解质溶液相互分开,该电池采用石墨电极,其工作原理示意如图。放电时正极反应式为_____,充电时质子的移动方向为_____(填“从左向右”或“从右向左”)。
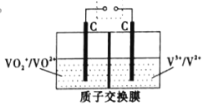
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com