
| A. | N2O5→HNO3 | B. | Cl-→ClO3- | C. | MnO2→Mn2+ | D. | H2→H2O |
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是描述微观粒子多少的物理量 | |
| B. | 物质的量将可称量的宏观物质与一定数目微观粒子联系起来 | |
| C. | 1molO2的质量为32g•mol-1 | |
| D. | 22.4L H2的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g O2与16g O3所含的原子数均是NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA | |
| C. | 标准状况下,2.24LCCl4所含原子数为0.5NA | |
| D. | 标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成N2为5.6L | |
| B. | 有0.3mol NO 被还原 | |
| C. | 生成氧化产物4.2g | |
| D. | 原混合物中NO 和NH3的物质的量之比可能为3:22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
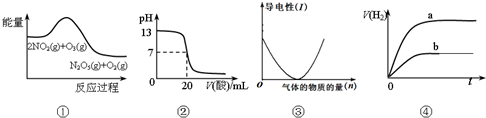
| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入醋酸体积的变化 | |
| C. | ③可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
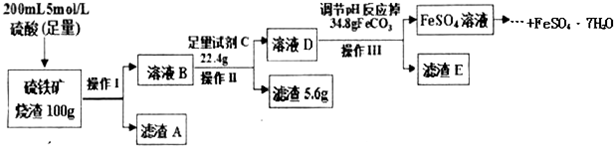
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com