
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是________。
(2)XY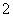 离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
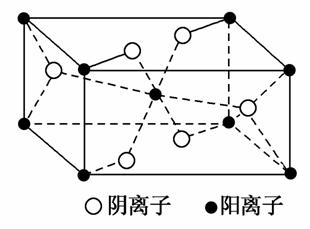
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是_________________________________。
解析 分子式为XY2的红棕色气体为NO2,故X为N元素,Y为O元素,M层与K层电子数相等的基态原子的电子排布式为1s22s22p63s2,则Z为Mg元素,+2价离子的3d轨道上有9个电子的原子的外围电子排布为3d104s1,则R为Cu元素。(1)O元素基态原子的电子排布式为1s22s22p4;第三周期元素中第一电离能最大的主族元素为Cl元素。
(2)NO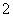 与O3为等电子体,两者结构相似,为Ⅴ形;在Cu2+的水合离子中,O原子提供孤电子对,Cu2+提供空轨道。(3)由晶胞结构可看出,阳离子位于顶点和体心,故阳离子个数=
与O3为等电子体,两者结构相似,为Ⅴ形;在Cu2+的水合离子中,O原子提供孤电子对,Cu2+提供空轨道。(3)由晶胞结构可看出,阳离子位于顶点和体心,故阳离子个数= ×8+1=2个,阴离子位于面心和体内,故阴离子个数=
×8+1=2个,阴离子位于面心和体内,故阴离子个数=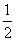 ×4+2=4个,故阴离子与阳离子个数比为2:1。(4)深蓝色溶液中含有的离子为[Cu(NH3)4]2+,根据得失电子守恒、电荷守恒以及原子守恒可写出离子方程式。
×4+2=4个,故阴离子与阳离子个数比为2:1。(4)深蓝色溶液中含有的离子为[Cu(NH3)4]2+,根据得失电子守恒、电荷守恒以及原子守恒可写出离子方程式。
答案 (1)①1s22s22p4 ②Cl
(2)①Ⅴ形 ②O
(3)2:1
(4)2Cu+8NH3·H2O+O2===2[Cu(NH3)4]2++4OH-+6H2O


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列现象或应用中,不能用胶体知识解释的是( )
A.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
B.用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
查看答案和解析>>
科目:高中化学 来源: 题型:

如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( )
A.该装置将化学能转化为电能
B.电子移动方向由a极到b极
C.可以用水代替SO(CH3)2作溶剂
D.b极反应式是FeS2+4Li++4e-===Fe+2Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极。
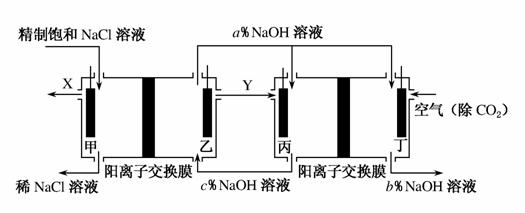
(1)为了有效除去粗盐中混有的Ca2+、Mg2+、SO ,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
A.先加足量Ba(OH)2,再加足量Na2CO3,最后加入适量稀盐酸
B.先加足量NaOH,再加足量Na2CO3,然后加足量BaCl2,最后加入适量稀盐酸
C.先加足量Na2CO3,再加足量BaCl2,然后加足量NaOH,最后加入适量稀盐酸
D.先加足量Ba(NO3)2,再加足量NaOH,然后加足量Na2CO3,最后加入适量稀盐酸
(2)丙电极为________极,该电极的电极反应式为____________________________________。
(3)乙电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(4)若装置中通过0.5 mol e-,则理论上生成标准状况下X的体积为________。
(5)图中NaOH溶液的质量分数a%、b%、c%由大到小的顺序为________。
(6)这样设计的主要节能之处在于(任写1条)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯,二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
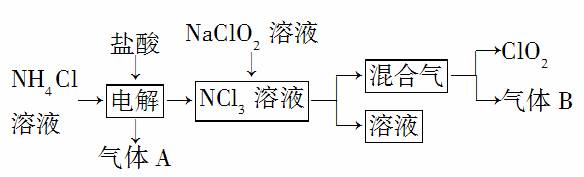
(1)ClO2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________(填 选项字母)。
选项字母)。
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是( )
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室区要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产物难以分离,还可能污染环境。写出该方法发生反应的化学方程式________________________。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是______________________,此法相比欧洲方法的优点是___________________________________________________________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为
_______________________________________________________。
此法提高了生产及储存、运输的安全性,原因是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式为MnO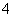 +NO
+NO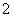 +
+ —→Mn2++NO
—→Mn2++NO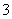 +H2O。下列叙述中正确的是( )
+H2O。下列叙述中正确的是( )
A.该反应中NO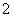 被还原
被还原
B.反应过程中溶液的pH减小
C.生成1 mol NaNO3需消耗0.4 mol KMnO4
D. 中的粒子是OH-
中的粒子是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如表所示,据此将乙二醇和丙三醇互相分离的最佳方法是 ( )
| 物质 | 分子式 | 熔点 (℃) | 沸点 (℃) | 密度 (g·cm-3) | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和酒精 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精 以任意比互溶 |
A.萃取法 B.结晶法
C.分液法 D.蒸馏法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com