
����Ŀ��һ���¶��¿��淴Ӧ��A(s)��2B(g) ![]() 2C(g)��D(g)��H��0���ֽ�1 mol A��2 mol B����������У���4 mol C��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ����
2C(g)��D(g)��H��0���ֽ�1 mol A��2 mol B����������У���4 mol C��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ����

A�������¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1 mol A��2 mol B���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2��
B�����ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B���������������
C�������¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ(t1ǰ�ķ�Ӧ���ʱ仯��ʡ��)
D�������¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C �����������2��
������C
��������
������������ݵ�Чƽ�������4molC��2molD�൱��2molA��4molB���������������ݻ��Ǽ�2���������ʵ���Ũ����ͬ����������ͬ�����´ﵽ��ͬƽ��״̬��A�������¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1molA��2molB���൱������ѹǿ��ƽ�����淴Ӧ�����ƶ����ﵽƽ��ʱ����C��Ũ��С��ԭ����2��������C��Ũ��С������C��Ũ�ȵ�2����A����B�����ֻ���λ�ò��䣬�����¶ȣ�ƽ�����淴Ӧ�����ƶ����ס�����B���������������B����C�������¶Ⱥ�����������ϡ�����壬û�иı������Ũ�ȣ��Է�Ӧ����û��Ӱ�죬������ͼ2��ʾ�������¶Ⱥ�ѹǿ���䣬����ϡ�����壬�൱�������������������Ũ�ȼ�С����Ӧ���ʼ�С���������Ũ�ȼ�С�ij̶ȴ�Щ����ѧƽ�������ƶ���������ͼ3��ʾ��C��ȷ��D�������¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��൱�������ҵ�ѹǿ��ƽ�����淴Ӧ�����ƶ�����С��ѹǿƽ��������Ӧ�����ƶ����ﵽ�µ�ƽ�������C���������С�ڼ���C�����������2����D����ѡC��


 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��1�¡��й���ѧ�������������� 113�š�115�š�117�ź�118������Ԫ�ر�����Ԫ�����ڱ�������118��Ԫ�ص�ԭ�ӷ���Ϊ294 118Uuo����294����ָ��ԭ�ӵ�
A. ԭ������ B. ������ C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A����״���£�2.24�̱����еķ�����Ϊ0.1NA
B����״���£�11.2�������к��й��ۼ�����ĿΪ��NA
C�������£�1mol�ǻ��к��еĵ�����Ϊ��NA
D��1mol�������1mol�Ҵ���Ũ��������³�ַ�Ӧ����H2O����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӽṹ�ĽǶȿ��������Ǹ��õ������л���Ļ�ѧ���ʡ�
��1�� ��Ȳ��һ����Ҫ�Ļ���ԭ�ϣ�����Ȳͨ��[Cu��NH3��2]Cl��Һ����Cu2C2����ɫ������Cu+��̬��������Ų�ʽΪ____________����Ȳ�������ᷴӦ�ɵñ�ϩ��H2C=CH-C��N����ϩ�������̼ԭ�ӹ���ӻ�������____________��[Cu��NH3��2]Cl�İ�ˮ��Һ�ڿ����з���Ѹ������ɫ��Ϊ����ɫ��д���ù��̵����ӷ���ʽ______________________��
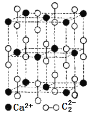
��2��ʵ��������Ȳʹ�õĵ�ʯ��Ҫ����̼���ƣ�д��̼���Ƶĵ���ʽ______________�� CaC2����ľ����ṹ��NaCl�������������ͼ��ʾ������CaC2��������������![]() �Ĵ��ڣ�ʹ������һ������������CaC2������1��Ca2+��Χ���������
�Ĵ��ڣ�ʹ������һ������������CaC2������1��Ca2+��Χ���������![]() ��ĿΪ____________����֪CaC2������ܶ�Ϊ2.22g/cm3���þ��������Ϊ____________cm3
��ĿΪ____________����֪CaC2������ܶ�Ϊ2.22g/cm3���þ��������Ϊ____________cm3
��3�� �״��������ɵõ���ȩ����ȩ�����е����Ǵ�ԼΪ____________���״��ķе�ȼ�ȩ�ĸߣ�����Ҫԭ����_____________________��
��4����֪�������������ԣ���Ka=1.1 ��10-10��ˮ�����һ�������γɵ�����Ϊ![]() �ж���ͬ�¶��µ���ƽ�ⳣ��Ka2��ˮ������_______Ka�����������>����<��������ԭ����___��
�ж���ͬ�¶��µ���ƽ�ⳣ��Ka2��ˮ������_______Ka�����������>����<��������ԭ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����������Ԫ��(A��B��C��D��E�ֱ����Ԫ�ط���)��������ԭ����������������A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ����BԪ������������Ӧ��ˮ���������⻯�ﷴӦ����һ����X��D��Aͬ����������Eͬ������EԪ��ԭ�ӵ��������������������������3/4����C��Eͬ������
��ش��������⣺
��1��X�Ļ�ѧʽΪ_____ _��Ԫ��D��E�γɵ���ʽ�εĵ���ʽ��___ __��
��2��Ԫ���ķǽ�����C��E��ǿ���Ƚϣ����и����У���˵����һ���۵���ʵ��_____(�����)��
���⻯��H2E�����Ա�H2Cǿ
���⻯��H2C�����ȶ��Ա�H2Eǿ
���⻯��H2E��ˮ��Һ�����ڿ����л�����
��3������BC��BC2��ɵĻ������ͨ����ͼ��ʾװ���У�������֤Ũ����������Ա�ϡ�����������ǿ��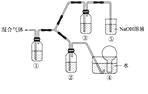
��֪(��) Ũ�����ܽ�����BC������BC2����ϡ���������BC��
(��) NaOH��Һ��BC2��Ӧ�Ļ�ѧ����ʽΪ��2NaOH+2BC2�TNaBC2+NaBC3+H2O ��NaOH��Һ��BC���岻��Ӧ��
a��װ����������ʢ�ŵ�ҩƷ������______��______��
b���ܹ�˵��ʵ���ѳɹ��������� __ ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�����ݷ�ӦAsO43-+2I-+2H+![]() AsO33-+I2+H2O�����ͼԭ�����̽��pH��AsO43-��������Ӱ������õ�ѹ��pH����ϵ��ͼ�������й������������
AsO33-+I2+H2O�����ͼԭ�����̽��pH��AsO43-��������Ӱ������õ�ѹ��pH����ϵ��ͼ�������й������������
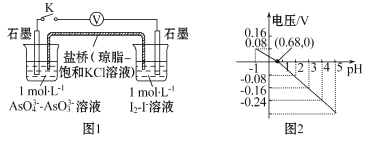
A������pH���Ըı䷴Ӧ�ķ���
B��pH=0.68ʱ,��Ӧ����ƽ��״̬
C��pH=5ʱ, �����缫��ӦʽΪ2I-��2e -= I2
D��pH��0.68ʱ,������I2��AsO43-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1����֪���з�Ӧ��SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ��H1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ��H2 CaSO4(s) ==Ca2+��aq��+SO42��aq�� ��H3
��ӦSO2(g)+ Ca2+��aq��+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)����H=______��(����H1 ��H2��H3��ʾ)
��2����ҵ����H2��Cl2��Ӧ��HCl������������Ϊ��H��H��436kJ/mol��Cl��Cl��243kJ/mol��H��Cl��431kJ/mol���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��3���ϳ�����CO��H2Ϊ���Ļ�����壩��������Ҫ��ȼ��Ҳ����Ҫ�Ļ���ԭ�ϣ��Ʊ��ϳ����ķ����ж��֣��ü����Ʊ��ϳ����ķ�ӦΪ��
��2CH4��g��+O2��g���T2CO��g��+4H2��g������H1=��72kJ��mol��1
��CH4��g��+H2O��g���TCO��g��+3H2��g������H2=+216kJ��mol��1
������������Ӧ����ˮ�������Ȼ�ѧ����ʽΪ ��
����1mol��H2O��g����O2��ɵĻ��������O2���������Ϊx�����˻����������CH4��ַ�Ӧ����x=0.2ʱ����Ӧ���ų�������Ϊ kJ����x= ʱ����Ӧ�������ų��������գ���������Ϊ0��
��4�� һ����������ˮ��Һ��1 mol Cl����1 mol ClOx��(x��1��2��3��4)������(KJ)��Դ�С��ͼ��ʾ
��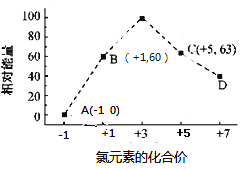
��D�� (�����ӷ���)��
��B��A��C��Ӧ���Ȼ�ѧ����ʽΪ (�����ӷ��ű�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��

������һ�����ʵ���Ũ�ȵ�Ӳ֬��ı���Һ��
���ⶨ�ӽ�ͷ�ιܵγ���ÿ��Һ��������
���ⶨ��ˮ��ˮ�����γ�Ӳ֬�ᵥ����Ĥ����Ӳ֬�ᱽ��Һ�ĵ�����(����ͼ��ʾ)�ý�ͷ�ι�
��ȡӲ֬��ı���Һ����ֱ��ˮ���е�һ�Σ�������ˮ����ȫ���ӷ���Ӳ֬�������ˮ����ɢ������������ʱ���ٵεڶ��Σ������ε��£�ֱ������ˮ���γɵ������Ӻ��Ӳ֬��������γɵ�ĤΪֹ(�õ�����Ĥ�����ǽ������еģ���ʱ���ٵ���Ӳ֬����Һ������Һ��ˮ���ϲ�����ɢ)��
������ˮ����ˮ�ı������
��������ð����ӵ�������
��1���ڵ�һ��ʵ���У���ȡһ��������Ӳ֬���������Һ����IJ���������Ҫ�� �� �� ��
��2���ڶ���ʵ�飬�ⶨ�ӽ�ͷ�ιܵγ���ÿ��Һ�����������÷�����
��3����Ӳ֬�ᱽ��Һ��Ũ��Ϊc molL��1����ý�ͷ�ιܵγ���ÿ����Һ�����ΪV mL��ˮ�����γ�Ӳ֬�ᵥ����Ĥʱ���µ�Ӳ֬����Һ�ĵ���Ϊd��ˮ����ˮ�ı����ΪS cm2��ÿ��Ӳ֬����ӵĽ����ΪA cm2�����ӵ�����NA(��c��V��d��S��A�Ĵ���ʽ��ʾ)�� ��
��4����ˮ�к�����������������Һ�����Բⶨ��NAֵ�к�Ӱ�죿 (ѡ����ƫ��������ƫС��������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������;�㷺�Ľ��������������������ײ����к��ĺ�����ҵ��ˮ��
I����ԭ�������Ǵ�����Cr2O42�� ��CrO72����ҵ��ˮ��һ�ֳ��÷������乤���������£�
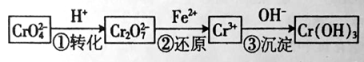
���е���������ƽ�⣺2CrO42��(��ɫ)+2H+![]() Cr2O72�� (��ɫ)+H2O
Cr2O72�� (��ɫ)+H2O
��1����ƽ����ϵ�У�pH=0ʱ��Һ�� ɫ��
��2����ʯīΪ�缫�����Na2CrO4�Ʊ�Na2Cr2O7��װ����ͼ��ʾ��
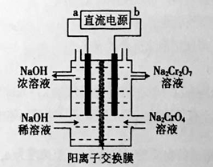
a���������� ��b��ֱ������һ���ķ�ӦʽΪ ��
��3����������Ӧ�����ӷ���ʽ�� ��
��������Ӧ�����Һ����һ�����ռ����Һ��c(Fe3+)=2.0��10��12mol��L��1������Һ��c(Cr3+)= mol��L��1��(��֪Ksp[Fe(OH)3]=4.0��10��38 mol��L��1��Ksp[Cr(OH)3]=6.0x10��31 mol��L��1)��
II��̽��CrO3��ǿ�����Ժ����ȶ���
��4��CrO3���л���(��ƾ�)ʱ���ҷ�Ӧ�����Ż����ù������Ҵ������������ᣬCrO3����ԭ����ɫ��Cr2(SO4)3�����䲢��ƽ���з�Ӧʽ��
aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fR
b��c��f= ��
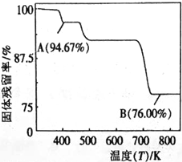
��5��CrO3�����ȶ��Բ����ʱ�ֽ⣬��̶����������¶ȵı仯��ͼ��ʾ��B��ʱ���ɹ���Ļ�ѧʽΪ ��(���������= ![]() )
)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com