
”¾ĢāÄæ”æĪĀ¶ČĪŖ![]() Ź±£¬ŌŚČżøöČŻ»ż¾łĪŖ
Ź±£¬ŌŚČżøöČŻ»ż¾łĪŖ![]() µÄŗćČŻĆܱÕČŻĘ÷ÖŠ½ö·¢Éś·“Ó¦£ŗ
µÄŗćČŻĆܱÕČŻĘ÷ÖŠ½ö·¢Éś·“Ó¦£ŗ![]() Õż·“Ó¦ĪüČČ
Õż·“Ó¦ĪüČČ![]() ”£ŹµŃé²āµĆ£ŗ
”£ŹµŃé²āµĆ£ŗ![]() £¬
£¬![]() £¬
£¬![]() ”¢
”¢![]() ĪŖĖŁĀŹ³£Źż£¬ŹÜĪĀ¶ČÓ°Ļģ”£Ę½ŗā³£Źż
ĪŖĖŁĀŹ³£Źż£¬ŹÜĪĀ¶ČÓ°Ļģ”£Ę½ŗā³£Źż![]() ŹĒÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹
ŹĒÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹![]() ×ÜŃ¹
×ÜŃ¹![]() ĪļÖŹµÄĮæ·ÖŹż”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
ĪļÖŹµÄĮæ·ÖŹż”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ![]()
![]()
ČŻĘ÷ ±ąŗÅ | ĪļÖŹµÄĘšŹ¼ÅØ¶Č | ĪļÖŹµÄĘ½ŗāÅØ¶Č | ||
|
|
|
| |
¢ń |
| 0 | 0 |
|
¢ņ |
|
|
| |
¢ó | 0 |
|
| |
A.“ļĘ½ŗāŹ±£¬ČŻĘ÷¢ņÖŠ![]() ±ČČŻĘ÷¢ńÖŠµÄŠ”
±ČČŻĘ÷¢ńÖŠµÄŠ”
B.ČŻĘ÷¢ņ·“Ó¦“ļĘ½ŗāĒ°£¬![]()
C.ĘšŹ¼Ź±ČŻĘ÷¢ńÖŠ×ÜŃ¹ĒæĪŖ![]() £¬Ōņ
£¬Ōņ![]() Ź±øĆ·“Ó¦µÄĘ½ŗā³£Źż
Ź±øĆ·“Ó¦µÄĘ½ŗā³£Źż![]() kPa
kPa
D.µ±ĪĀ¶ČøıäĪŖ![]() Ź±£¬Čō
Ź±£¬Čō![]() Ōņ
Ōņ![]()
”¾“š°ø”æD
”¾½āĪö”æ
A.IÖŠµÄ·“Ó¦![]()
![]()
æŖŹ¼![]() 0 0
0 0
·“Ó¦![]()
![]()
![]()
Ę½ŗā![]()
![]()
![]()
»ÆŃ§Ę½ŗā³£Źż![]() £¬Čē¹ū¢ņÖŠĘ½ŗāŹ±
£¬Čē¹ū¢ņÖŠĘ½ŗāŹ±![]() £¬Éč²Ī¼Ó·“Ó¦µÄ
£¬Éč²Ī¼Ó·“Ó¦µÄ![]() £¬Ōņ
£¬Ōņ![]() £¬
£¬![]() £¬Ę½ŗāŹ±
£¬Ę½ŗāŹ±![]() £¬
£¬![]() £¬¢ņÖŠ
£¬¢ņÖŠ £¬ĖµĆ÷IIÖŠĘ½ŗāŹ±Ó¦øĆ“ęŌŚ
£¬ĖµĆ÷IIÖŠĘ½ŗāŹ±Ó¦øĆ“ęŌŚ![]() £¬ČŻĘ÷IÖŠ
£¬ČŻĘ÷IÖŠ![]() £¬ĖłŅŌ“ļĘ½ŗāŹ±£¬ČŻĘ÷¢ņÖŠ
£¬ĖłŅŌ“ļĘ½ŗāŹ±£¬ČŻĘ÷¢ņÖŠ![]() Š”ÓŚ1£¬ČŻĘ÷¢ņÖŠ
Š”ÓŚ1£¬ČŻĘ÷¢ņÖŠ![]() ±ČČŻĘ÷¢ńÖŠµÄŠ”£¬¹ŹAÕżČ·£»
±ČČŻĘ÷¢ńÖŠµÄŠ”£¬¹ŹAÕżČ·£»
B. øł¾ŻAŃ”Ļī£¬Ę½ŗā³£ŹżK=1£¬![]() £¬·“Ó¦ĻņÕż·½Ļņ½ųŠŠ£¬ĖłŅŌ
£¬·“Ó¦ĻņÕż·½Ļņ½ųŠŠ£¬ĖłŅŌ![]() £¬¹ŹBÕżČ·£»
£¬¹ŹBÕżČ·£»
C. IÖŠµÄ·“Ó¦![]()
![]()
æŖŹ¼![]() 0 0
0 0
·“Ó¦![]()
![]()
![]()
Ę½ŗā![]()
![]()
![]()
Ę½ŗāŹ±×ÜŃ¹ĒæĪŖ![]() £¬Ōņ
£¬Ōņ![]() Ź±øĆ·“Ó¦µÄĘ½ŗā³£Źż
Ź±øĆ·“Ó¦µÄĘ½ŗā³£Źż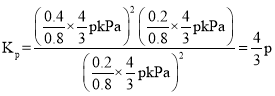 kPa¹ŹCÕżČ·£»
kPa¹ŹCÕżČ·£»
D.![]() £¬
£¬![]() £¬“ļµ½Ę½ŗāדĢ¬Ź±ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬Ōņ
£¬“ļµ½Ę½ŗāדĢ¬Ź±ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬Ōņ![]() £¬Čō
£¬Čō![]() £¬Ōņ
£¬Ōņ![]() £¬»ÆŃ§Ę½ŗā³£ŹżKµČÓŚ1£¬øĆĪĀ¶ČĻĀµÄK“óÓŚ
£¬»ÆŃ§Ę½ŗā³£ŹżKµČÓŚ1£¬øĆĪĀ¶ČĻĀµÄK“óÓŚ![]() £¬ĒŅøĆ·“Ó¦µÄÕż·“Ó¦ŹĒĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬KŌö“ó£¬ĖłŅŌ
£¬ĒŅøĆ·“Ó¦µÄÕż·“Ó¦ŹĒĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬KŌö“ó£¬ĖłŅŌ![]() £¬¹ŹD“ķĪó
£¬¹ŹD“ķĪó
¹ŹŃ”D”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ![]() ×÷ĪŖŅ»ÖÖÖŲŅŖ»Æ¹¤ŌĮĻ£¬±»“óĮæÓ¦ÓĆÓŚ¹¤ŅµÉś²ś£¬ÓėĘäÓŠ¹ŲŠŌÖŹ·“Ó¦µÄ“߻ƼĮŃŠ¾æŌų±»ĮŠČė¹ś¼Ņ863¼Ę»®”£
×÷ĪŖŅ»ÖÖÖŲŅŖ»Æ¹¤ŌĮĻ£¬±»“óĮæÓ¦ÓĆÓŚ¹¤ŅµÉś²ś£¬ÓėĘäÓŠ¹ŲŠŌÖŹ·“Ó¦µÄ“߻ƼĮŃŠ¾æŌų±»ĮŠČė¹ś¼Ņ863¼Ę»®”£
(1)“߻ƼĮ³£¾ßÓŠ½ĻĒæµÄŃ”ŌńŠŌ£¬¼“×ØŅ»ŠŌ”£ŅŃÖŖ£ŗ
·“Ó¦I£ŗ![]()
·“Ó¦II£ŗ![]()
Š“³öNO·Ö½āÉś³É![]() Óė
Óė![]() µÄČČ»Æѧ·½³ĢŹ½______”£
µÄČČ»Æѧ·½³ĢŹ½______”£
(2)ŌŚŗćĪĀŗćȯװÖĆÖŠ³äČėŅ»¶ØĮæµÄ![]() ŗĶ
ŗĶ![]() £¬ŌŚÄ³“߻ƼĮµÄ×÷ÓĆĻĀ½ųŠŠ·“Ó¦I£¬²āµĆ²»Ķ¬Ź±¼äµÄ
£¬ŌŚÄ³“߻ƼĮµÄ×÷ÓĆĻĀ½ųŠŠ·“Ó¦I£¬²āµĆ²»Ķ¬Ź±¼äµÄ![]() ŗĶ
ŗĶ![]() £¬µÄÅضČČē±ķ£ŗ
£¬µÄÅضČČē±ķ£ŗ
Ź±¼ä | 0 | 5 | 10 | 15 | 20 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
ŌņĻĀĮŠÓŠ¹ŲŠšŹöÖŠÕżČ·µÄŹĒ______”£
A.Ź¹ÓĆ“ß»Æ¼ĮŹ±£¬æɽµµĶøĆ·“Ó¦µÄ»ī»ÆÄÜ£¬¼ÓæģĘä·“Ó¦ĖŁĀŹ
B.Čō²āµĆČŻĘ÷ÄŚ![]() Ź±£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā
Ź±£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā
C.µ±ČŻĘ÷ÄŚ![]() Ź±£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā
Ź±£¬ĖµĆ÷·“Ó¦ŅŃ“ļĘ½ŗā
D.Ē°10·ÖÖÓÄŚµÄĘ½¾łĖŁĀŹ![]()
![]()
(3)°±“ß»ÆŃõ»ÆŹ±»į·¢ÉśÉĻŹöĮ½øö¾ŗÕł·“Ó¦I”¢![]() ĪŖ·ÖĪöij“߻ƼĮ¶ŌøĆ·“Ó¦µÄŃ”ŌńŠŌ£¬ŌŚ1LĆܱÕČŻĘ÷ÖŠ³äČė1mol
ĪŖ·ÖĪöij“߻ƼĮ¶ŌøĆ·“Ó¦µÄŃ”ŌńŠŌ£¬ŌŚ1LĆܱÕČŻĘ÷ÖŠ³äČė1mol![]() ŗĶ2mol
ŗĶ2mol![]() £¬²āµĆÓŠ¹ŲĪļÖŹµÄĮæ¹ŲĻµČēĶ¼1£ŗ
£¬²āµĆÓŠ¹ŲĪļÖŹµÄĮæ¹ŲĻµČēĶ¼1£ŗ

¢ŁøĆ“ß»Æ¼ĮŌŚµĶĪĀŹ±Ń”Ōń·“Ó¦______![]() Ģī”°I”±»ņ”°II”±
Ģī”°I”±»ņ”°II”±![]() ”£
ӣ
¢Ś![]() Ź±£¬
Ź±£¬![]() µÄĘ½ŗā³£Źż
µÄĘ½ŗā³£Źż![]() ______
______![]() ²»ŅŖĒóµĆ³ö¼ĘĖć½į¹ū£¬Ö»ŠčĮŠ³öŹż×Ö¼ĘĖćŹ½
²»ŅŖĒóµĆ³ö¼ĘĖć½į¹ū£¬Ö»ŠčĮŠ³öŹż×Ö¼ĘĖćŹ½![]() ”£
ӣ
¢Ū![]() µć±ČBµćĖł²śÉśµÄNOµÄĪļÖŹµÄĮæÉŁµÄÖ÷ŅŖŌŅņ______”£
µć±ČBµćĖł²śÉśµÄNOµÄĪļÖŹµÄĮæÉŁµÄÖ÷ŅŖŌŅņ______”£
(4)ŗĻ³É°±¹¤Ņµ»į²śÉś“óĮæø±²śĪļ![]() £¬¹¤ŅµÉĻ³£ÓĆøßÅØ¶ČµÄ
£¬¹¤ŅµÉĻ³£ÓĆøßÅØ¶ČµÄ![]() ČÜŅŗĪüŹÕ
ČÜŅŗĪüŹÕ![]() £¬µĆČÜŅŗX£¬ŌŁĄūÓƵē½ā·ØŹ¹
£¬µĆČÜŅŗX£¬ŌŁĄūÓƵē½ā·ØŹ¹![]() ČÜŅŗŌŁÉś£¬Ęä×°ÖĆČēĶ¼2ĖłŹ¾£ŗ
ČÜŅŗŌŁÉś£¬Ęä×°ÖĆČēĶ¼2ĖłŹ¾£ŗ
¢ŁŌŚŃō¼«Ēų·¢ÉśµÄ·“Ó¦°üĄØ______ŗĶ![]() ”£
ӣ
¢Ś¼ņŹö![]() ŌŚŅõ¼«ĒųŌŁÉśµÄŌĄķ______”£
ŌŚŅõ¼«ĒųŌŁÉśµÄŌĄķ______”£
(5)Öʱø“߻ƼĮŹ±³£²śÉśŅ»¶ØµÄ·ĻŅŗ£¬¹¤ŅµÉĻ³£ĄūÓĆĒāĮņĖį¼ģ²āŗĶ³żČ„·ĻŅŗÖŠµÄ![]() ”£
ӣ
ŅŃÖŖ£ŗ![]() Ź±£¬
Ź±£¬![]() £¬
£¬![]() £¬
£¬![]()
¢ŁŌŚ¼ĘĖćČÜŅŗÖŠµÄĄė×ÓÅØ¶ČŹ±£¬Éę¼°ČõĖįµÄµēĄėĶس£ŅŖ½ųŠŠ½üĖĘ“¦Ąķ”£Ōņ![]() ĒāĮņĖįµÄ
ĒāĮņĖįµÄ![]() ______
______![]() Č”½üĖĘÕūŹż
Č”½üĖĘÕūŹż![]() ”£
ӣ
¢ŚŅŃÖŖ£¬Ä³·ĻŅŗ½Ó½üÓŚÖŠŠŌ£¬Čō¼ÓČėŹŹĮæµÄĒāĮņĖį£¬µ±·ĻŅŗÖŠ![]() ______
______![]() ¼ĘĖć½į¹ū±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö
¼ĘĖć½į¹ū±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö![]() £¬¾Ķ»į²śÉśCuS³Įµķ”£
£¬¾Ķ»į²śÉśCuS³Įµķ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÖø¶Ø·“Ó¦µÄĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ
A.MgĶ¶ČėĻ”HNO3ÖŠ£ŗMg£«2H+£½Mg2+£«H2”ü
B.MnO2ÓėÅØŃĪĖį»ģŗĻ¼ÓČČÖĘCl2£ŗMnO2£«4H+£«4Cl£![]() MnCl2£«Cl2”ü£«2H2O
MnCl2£«Cl2”ü£«2H2O
C.ĻņĻ”H2SO4ŗĶH2O2µÄ»ģŗĻŅŗÖŠ¼ÓČėCu·Ū£ŗ2H+£«H2O2£«Cu£½Cu2+£«2H2O
D.ĻņAlCl3ČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£ŗAl3+£«4NH3”¤H2O£½AlO![]() £«2H2O£«4NH
£«2H2O£«4NH![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļYÓĆÓŚŅ»ÖÖ湊ÄĀÉŹ§³£Ņ©µÄŗĻ³É£¬æÉÓÉ»ÆŗĻĪļXŌŚŅ»¶ØĢõ¼žĻĀÖʵƔ£ĻĀĮŠÓŠ¹Ų»ÆŗĻĪļX”¢YµÄĖµ·ØÕżČ·µÄŹĒ

A.X·Ö×ÓÖŠĖłÓŠŌ×ÓæÉÄÜŌŚĶ¬Ņ»Ę½ĆęÄŚ
B.1 mol Y×ī¶ąÄÜÓė4 mol H2·¢Éś¼Ó³É·“Ó¦
C.X”śYµÄ·“Ó¦ĄąŠĶĪŖ¼Ó³É·“Ó¦
D.ÓĆFeCl3ČÜŅŗæɼģŃéYÖŠŹĒ·ńŗ¬ÓŠX
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®ŹĒŅ»ÖÖÖŲŅŖµÄ×ŌȻ׏Ō“£¬ŹĒČĖĄąĄµŅŌÉś“ę²»æÉȱɣµÄĪļÖŹ£¬Ė®ÖŹÓÅĮÓÖ±½ÓÓ°ĻģČĖĢ彔浣¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ä³Ę¶Ą§É½Ēų£¬ĪŖĮĖŃ°ÕŅŗĻŹŹµÄŅūÓĆĖ®£¬¶ŌɽÉĻµÄČŖĖ®½ųŠŠĮĖ·ÖĪö»ÆŃ飬½į¹ūĻŌŹ¾£¬Ė®ÖŠÖ÷ŅŖŗ¬Ca2+”¢Mg2+”¢Cl©ŗĶSO42©”£ŌņøĆÓ²Ė®ŹōÓŚ_____(Ģī”°ŌŻŹ±”±»ņ”°ÓĄ¾Ć”±)Ó²¶Č£¬ČōŅŖ³żČ„Ca2+”¢Mg2+£¬æÉŅŌĶłĖ®ÖŠ¼ÓČėŹÆ»ŅŗĶ“æ¼ī£¬ŹŌ¼Į¼ÓČėŹ±ĻČ¼Ó______ŗó¼Ó___________”£
£Ø2£©ĪŅ¹ś¹ę¶ØŅūÓĆĖ®µÄÓ²¶Č²»Äܳ¬¹ż25¶Č£¬Ó²¶ČµÄ±ķŹ¾·½·ØŹĒ£ŗ½«Ė®ÖŠµÄCa2+ŗĶMg2+¶¼æ“×÷Ca2+£¬²¢½«ĘäÕŪĖć³ÉCaOµÄÖŹĮ棬Ķس£°Ń1ÉżĖ®ÖŠŗ¬ÓŠ10mg CaO³ĘĪŖ1¶Č£¬Ä³»ÆѧŹµŃ銔×é¶Ō±¾µŲĒųµŲĻĀĖ®µÄÓ²¶Č½ųŠŠ¼ģ²ā”£
ŹµŃéÖŠÉę¼°µÄ²æ·Ö·“Ó¦£ŗ
M2+(½šŹōĄė×Ó)+EBT©(øõŗŚT)ØTMEBT+
Ą¶É« ¾ĘŗģÉ«
M2+(½šŹōĄė×Ó)+Y4©(EDTA)ØTMY2©
MEBT++Y4©(EDTA)ØTMY2©+EBT©(øõŗŚT )
ŹµŃé¹ż³Ģ£ŗ
¢ŁČ”µŲĻĀĖ®ŃłĘ·25.00mL½ųŠŠŌ¤“¦Ąķ£¬Š“³öÓÉMg2+ŅżĘšµÄŌŻŹ±Ó²¶ČµÄĖ®ÓĆ¼ÓČČ·½·Ø“¦ĄķŹ±Ėł·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_______________”£
¢ŚŌ¤“¦ĄķµÄ·½·ØŹĒĻņĖ®ŃłÖŠ¼ÓČėÅØŃĪĖį£¬Ö󷊼ø·ÖÖÓ£¬Ö󷊵ÄÄæµÄŹĒ______________”£
¢Ū½«“¦ĄķŗóµÄĖ®Ńł×ŖŅʵ½250mLµÄ׶ŠĪĘæÖŠ£¬¼ÓČė°±Ė®©ĀČ»Æļ§»ŗ³åČÜŅŗµ÷½ŚpHĪŖ10£¬µĪ¼Ó¼øµĪøõŗŚTČÜŅŗ£¬ÓĆ0.010 00molL©1µÄEDTA±ź×¼ČÜŅŗ½ųŠŠµĪ¶Ø£¬µĪ¶ØÖÕµćŹ±¹²ĻūŗÄEDTAČÜŅŗ15.00mL£¬ŌņøƵŲĻĀĖ®µÄÓ²¶ČĪŖ________________”£
£Ø3£©Ä³¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠCN©ŗĶCr2O72©µČĄė×Ó£¬Šč¾ĪŪĖ®“¦Ąķ“ļ±źŗó²ÅÄÜÅÅ·Å£¬ĪŪĖ®“¦Ąķ³§ÄāÓĆĻĀĮŠĮ÷³Ģ½ųŠŠ“¦Ąķ£ŗ

»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁĮ÷³Ģ¢ŚÖŠ£¬·“Ó¦ŗóĪŽĘųĢå·Å³ö£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ______________________”£
¢Śŗ¬Cr3+·ĻĖ®Šč½ųŅ»²½“¦Ąķ£¬ĒėÄćÉč¼ĘŅ»øö“¦Ąķ·½°ø£ŗ________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗĻ³É°±¹¤ŅµÉę¼°¹ĢĢåČ¼ĮĻµÄĘų»Æ£¬ŠčŅŖŃŠ¾æCO2ÓėCOÖ®¼äµÄ×Ŗ»Æ”£ĪŖĮĖÅŖĒåĘä¹ęĀÉ£¬ČĆŅ»¶ØĮæµÄCO2Óė×ćĮæĢ¼ŌŚĢå»żæɱäµÄĆܱÕČŻĘ÷ÖŠ·“Ó¦£ŗC(s)£«CO2(g) ![]() 2CO(g) H£¬²āµĆŃ¹Ē攢ĪĀ¶Č¶ŌCO”¢CO2µÄĘ½ŗā×é³ÉµÄÓ°ĻģČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
2CO(g) H£¬²āµĆŃ¹Ē攢ĪĀ¶Č¶ŌCO”¢CO2µÄĘ½ŗā×é³ÉµÄÓ°ĻģČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©p1”¢p2”¢p3µÄ“󊔹ŲĻµŹĒ________£¬Ķ¼ÖŠa”¢b”¢cČżµć¶ŌÓ¦µÄĘ½ŗā³£Źż“󊔹ŲĻµŹĒ______________________”£
£Ø2£©Ņ»¶ØĢõ¼žĻĀ£¬ŌŚCO2Óė×ćĮæĢ¼·“Ó¦ĖłµĆĘ½ŗāĢåĻµÖŠ¼ÓČėH2ŗĶŹŹµ±“߻ƼĮ£¬ÓŠĻĀĮŠ·“Ó¦·¢Éś£ŗ·“Ó¦1£ŗCO(g)£«3H2(g) ![]() CH4(g)£«H2O(g) H1= a kJ/mol
CH4(g)£«H2O(g) H1= a kJ/mol
·“Ó¦2£ŗCO(g)£«H2O(g) ![]() CO2(g)£«H2(g) H2= b kJ/mol
CO2(g)£«H2(g) H2= b kJ/mol
¢Ł Ōņ¶žŃõ»ÆĢ¼ÓėĒāĘų·“Ó¦×Ŗ»ÆĪŖ¼×ĶéŗĶĖ®ÕōĘųµÄČČ»Æѧ·½³ĢŹ½ŹĒ____________”£
¢Ś ŅŃÖŖ298 KŹ±Ļą¹Ų»Æѧ¼ü¼üÄÜŹż¾ŻĪŖ£ŗ
»Æѧ¼ü | H”ŖH | O”ŖH | C”ŖH |
|
E/£ØkJ”¤mol-1£© | 436 | 465 | 413 | 1076 |
Ōņøł¾Ż¼üÄܼĘĖć£¬H1=________________”£·“Ó¦1×Ō·¢½ųŠŠµÄĢõ¼žŹĒ___________”££ØĢī”°½ĻøßĪĀ¶Č”±”¢”°½ĻµĶĪĀ¶Č”±”¢”°ČĪŅāĪĀ¶Č”±£©
£Ø3£©Ņ»¶ØĢõ¼žĻĀ£¬CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ¦¤H3£¬Ļņ¹Ģ¶ØČŻ»żĪŖ1 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol CO2ŗĶ6 mol H2£¬Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗāדĢ¬£¬²āµĆCH3OH(g)µÄĪļÖŹµÄĮæĪŖ1mol£¬Ōņ“ĖĢõ¼žĻĀøĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK =_________£ØÓĆ·ÖŹż±ķŹ¾£©£»ČōæŖŹ¼Ź±³äČė2 mol CH3OH(g) ŗĶ2 mol H2O(g)“ļµ½ĻąĶ¬Ę½ŗāדĢ¬Ź±£¬CH3OHµÄ×Ŗ»ÆĀŹĪŖ_______£»ČōĘ½ŗāŗóŌŁ³äČė4 molµÄN2£¬Ōņc(CO2)ŗĶŌĘ½ŗā±Č½ĻŹĒ_________”££ØĢī”°Ōö“ó”±”¢”°¼õŠ””±”¢”°²»±ä”±£©
CH3OH(g)+H2O(g) ¦¤H3£¬Ļņ¹Ģ¶ØČŻ»żĪŖ1 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol CO2ŗĶ6 mol H2£¬Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗāדĢ¬£¬²āµĆCH3OH(g)µÄĪļÖŹµÄĮæĪŖ1mol£¬Ōņ“ĖĢõ¼žĻĀøĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK =_________£ØÓĆ·ÖŹż±ķŹ¾£©£»ČōæŖŹ¼Ź±³äČė2 mol CH3OH(g) ŗĶ2 mol H2O(g)“ļµ½ĻąĶ¬Ę½ŗāדĢ¬Ź±£¬CH3OHµÄ×Ŗ»ÆĀŹĪŖ_______£»ČōĘ½ŗāŗóŌŁ³äČė4 molµÄN2£¬Ōņc(CO2)ŗĶŌĘ½ŗā±Č½ĻŹĒ_________”££ØĢī”°Ōö“ó”±”¢”°¼õŠ””±”¢”°²»±ä”±£©
£Ø4£©ČēĶ¼ŹĒ¼×“¼Č¼ĮĻµē³Ų¹¤×÷µÄŹ¾ŅāĶ¼£¬ĘäÖŠA”¢B”¢D¾łĪŖŹÆÄ«µē¼«£¬CĪŖĶµē¼«”£¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬶ĻæŖK£¬“ĖŹ±A”¢BĮ½¼«ÉĻ²śÉśµÄĘųĢåĢå»żĻąĶ¬”£

¢Ł¼×ÖŠøŗ¼«µÄµē¼«·“Ź½ĪŖ_______________£¬±ūÖŠC¼«µÄµē¼«·“Ó¦Ź½ĪŖ___________”£
¢Ś ŅŅÖŠA¼«Īö³öµÄĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·“Ó¦3A£Øs£©+3B£Øg£©=2C£Øg£©+D£Øg£©£¬¾3 min£¬BµÄÅØ¶Č¼õÉŁ0£®9 mol”¤L-1”£¶Ō“Ė·“Ó¦ĖŁĀŹµÄ±ķŹ¾ÕżČ·µÄŹĒ£Ø £©
A£®ÓĆA±ķŹ¾µÄ·“Ó¦ĖŁĀŹŹĒ0£®4 mol”¤L-1”¤min-1
B£®·Ö±šÓĆB”¢C”¢D±ķŹ¾µÄ·“Ó¦ĖŁĀŹÖ®±ČŹĒ3”Ć2”Ć1
C£®ŌŚ2 minÄ©µÄ·“Ó¦ĖŁĀŹ£¬ÓĆB±ķŹ¾ŹĒ0£®3 mol”¤L-1”¤min-1
D£®ŌŚ2 minÄŚµÄ·“Ó¦ĖŁĀŹ£¬ÓĆC±ķŹ¾ŹĒ0£®3 mol”¤L-1”¤min-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢MŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£¬YµÄ×īĶā²ćµē×ÓŹżŹĒÄŚ²ćµē×ÓŹżµÄ3±¶£¬YÓėZŠĪ³ÉµÄ»ÆŗĻĪļZ2Y3ÖŠ£¬ŌŖĖŲÖŹĮæ±Čm£ØY£©£ŗm£ØZ£©£½8£ŗ9£»XŌ×ÓµÄ×īĶā²ćµē×ÓŹżĪŖMŌ×ÓŗĶZŌ×Ó×īĶā²ćµē×ÓŹżµÄŗĶµÄŅ»°ė”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.XµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļŅ»¶ØĪŖĒæĖįB.ĘųĢ¬Ēā»ÆĪļµÄ·Šµć£ŗY>M
C.ZŹĒµŲæĒÖŠŗ¬Įæ×ī¶ąµÄŌŖĖŲD.Ō×Ó°ė¾¶£ŗZ>M>X>Y
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśÓĆ0.10 mol”¤L£1±ź×¼NaOHČÜŅŗµĪ¶ØijÅØ¶ČµÄŃĪĖį”£¼ĒĀ¼Źż¾ŻČēĻĀ£ŗ
ŹµŃé ŠņŗÅ | “ż²āŅŗ Ģå»ż/mL | ĖłĻūŗÄNaOH±ź×¼ŅŗµÄĢå»ż/mL | |
µĪ¶ØĒ°¶ĮŹż/mL | µĪ¶Øŗó¶ĮŹż/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

£Ø1£©µĪ¶ØŹ±Ń”ÓĆ·ÓĢŖŹŌŅŗ×÷ÖøŹ¾¼Į£¬ČēŗĪÅŠ¶ĻµĪ¶Ø“ļµ½ÖÕµć____________”£
£Ø2£©µĪ¶Ø¹ż³ĢÖŠ£¬ŃŪ¾¦Ó¦×¢ŹÓ_____________________£»
£Ø3£©ŃĪĖįµÄĪļÖŹµÄĮæÅضČĪŖ___________”£
£Ø4£©¼īŹ½µĪ¶Ø¹Ü¼ā×ģ²æ·ÖÓŠĘųÅŻ£¬µĪ¶ØŗóĻūŹ§£¬¶Ō²ā¶Ø½į¹ūµÄÓ°ĻģŹĒ__________(Ģī”°Ę«øß”±”°Ę«µĶ”±»ņ”°ĪŽÓ°Ļģ”±)”£
£Ø5£©Ä³Ķ¬Ń§ÓĆŅŃÖŖ×¼Č·ÅØ¶ČµÄøßĆĢĖį¼ŲČÜŅŗµĪ¶ØČÜŅŗÖŠFe2£«µÄÅØ¶Č£¬øßĆĢĖį¼ŲČÜŅŗÓ¦Ź¢·ÅŌŚ________(Ģī”°¼×”±»ņ”°ŅŅ”±)ÖŠ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_______________
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com