
���� ��1������n=$\frac{m}{M}$����17gNH3�����ʵ�������Ӧ��Fe��OH��2��Fe��OH��3��NO3-��NH3�����ݵ���ת�Ƽ�������Fe��OH��3�����ʵ�����
��2����Ӧ��Al��AlO2-��AlԪ�ػ��ϼ���0������Ϊ+3�ۣ�������3�ۣ�NO3-��N2������Ԫ�ػ��ϼ���+5�۽���Ϊ0�ۣ�������10�ۣ����ϼ�������С������Ϊ30����Al��ϵ��Ϊ10��N2ϵ��Ϊ3����ϵ���غ㡢ԭ���غ���ƽ�������ʵ�ϵ����
��3�����ݵ���ת���غ�������ɵ��������ʵ������ٸ���V=nVm���㵪���������
��� �⣺��1��34gNH3�����ʵ���Ϊ$\frac{34g}{17g/mol}$����Ӧ��Fe��OH��2��Fe��OH��3��NO3-��NH3�����ݵ���ת�ƿ�֪������Fe��OH��3�����ʵ���Ϊ$\frac{2mol��[5-��-3��]}{3-2}$=16mol��
�ʴ�Ϊ��16��
��2����Ӧ��Al��AlO2-��AlԪ�ػ��ϼ���0������Ϊ+3�ۣ�������3�ۣ�NO3-��N2������Ԫ�ػ��ϼ���+5�۽���Ϊ0�ۣ�������10�ۣ����ϼ�������С������Ϊ30����Al��ϵ��Ϊ10��N2ϵ��Ϊ3���ɵ�Ԫ���غ��֪ϵ��Ϊ6����AlԪ���غ��֪ϵ��Ϊ10���ɵ���غ��֪ϵ��Ϊ����HԪ���غ��֪ϵ��Ϊ������ƽ�����ӷ���ʽΪ��10Al+6NO3-+4OH-=10AlO2-+3N2��+2H2O��
�ʴ�Ϊ��10��6��4��10��3��2��
��3�����ݵ���ת���غ㣬��0.3mol����ת��ʱ���ɵ��������ʵ���Ϊ$\frac{0.15mol}{2��5}$=0.015mol�����������Ϊ0.015mol��22.4L/mol=0.336L=336mL���ʴ�Ϊ��336��
���� ���⿼��������ԭ��Ӧ����ƽ�����㡢��������ȣ���Ŀ�ѶȲ������ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ��������ע��Ի���֪ʶ���������գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Һ©����Һʱ���ȴ����������²�Һ����ȫ�ֳ��ر��������ٴ��Ͽڵ����ϲ�Һ�� | |
| B�� | ȷ��ȡ25.00 mL��Һ���ѡ����Һ�ܡ���Ͳ��ζ��ܵ����� | |
| C�� | ���к��Ȳⶨʵ���У������NaOH��Һ��������m g����Ӧǰ����ϵ�¶ȱ仯����ӦҺ�ı�����Ϊc J•g-1•��-1��������1 molˮ�ų�������ΪkJ | |
| D�� | �ڳ���װ����ϴ�Ӿ���ʱ��Ϊ���پ����ܽ���ʧ��Ӧʹϴ�Ӽ�����ͨ����ֽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu2+��Fe2+ | B�� | Cu2+��Fe3+ | C�� | Fe2+��Fe3+ | D�� | Fe2+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a | B�� | 2a | C�� | 18a | D�� | 360a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
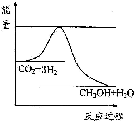 ��úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������
��úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������| ��ʼ Ũ�� | �� | �� | �� |
| c��H2��/mol/L | 0.010 | 0.020 | 0.020 |
| c��CO2��/mol/L | 0.010 | 0.010 | 0.020 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ճ������г��������ᣮ
�������ճ������г��������ᣮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȩ | B�� | ����ȩ��ͬϵ�� | ||
| C�� | CH3CH2COCH3 ��2-��ͪ�� | D�� | CH2=C��CH3��CHO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com