
| A. | ①④⑥ | B. | ②③⑤ | C. | ①④ | D. | 全部 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变,以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①单位时间内生成n molI2的同时生成2n molHI,正逆反应速率相等,反应达到平衡状态,故正确;
②单位时间内生成n mol H2的同时生成2n mol I2,方向相同,未成正比例,不能据此判断平衡状态,故错误;
③反应速率的比一直为2:2:1,不能判断平衡状态,故错误;
④混合气体颜色不再改变,碘的物质的量浓度不变,正逆反应速率相等,反应达到平衡状态,故正确;
⑤由于混合气体的质量和体积都未变,故混合气体的密度不再改变不能作为平衡状态的判断,故错误;
⑥该反应前后气体物质的量不变,所以无论是否达到平衡状态,压强始终不变,所以不能据此判断平衡状态,故错误;
故选C.
点评 本题考查化学平衡状态的判断,为高频考点,也是学生学习难点,注意:只有反应前后改变的物理量才能作为判断依据,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C2H5OH | D. | CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
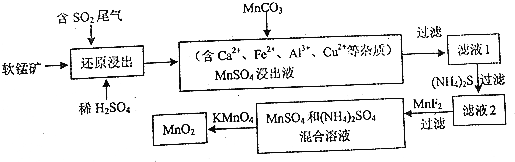
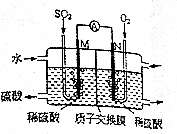
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
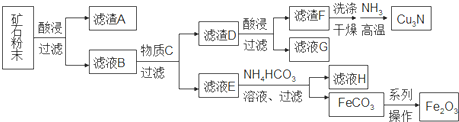
| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 在氨水中水分子和氨分子之间也存在着氢键 | |
| D. | 分子间作用力较弱,破坏它所需能量较少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定大于Y | B. | 第一电离能Y可能大于X | ||
| C. | 简单离子的半径:Xm->Yn- | D. | 气态氢化物的稳定性:HmX强于HnY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯和溴水混合后加入Fe粉制溴苯 | |
| B. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂已完全反应 | |
| C. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热煮沸,观察是否出现红色沉淀 | |
| D. | 探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
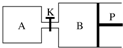 甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0
甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品名称 | 煤炭  | 酚醛树脂手柄 | 明矾  | 手工肥皂  |
| 主要成分 | C 碳单质 | 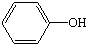 苯酚 | Al2(SO4)3•12H2O 十二水合硫酸铝 | C17H35COONa 硬脂酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com