
化学与生产、生活密切相关。下列叙述中,不正确的是
A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
B、用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同
C、钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
D.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
下列关于容量瓶的四种叙述:①是配制准确物质的量浓度的溶液的仪器;②不易储存溶液;
③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是
A.①②③④ B.②③ C.①②④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是

A.转移溶液 B.除去氯气中氯化氢 C.点燃 D.称量NaOH固体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上学期第一次质检化学试卷(解析版) 题型:实验题
I、某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
(1)图中装置缺少的一种仪器,该仪器名称为 。

(2)将反应混合液的 温度记为反应的终止温度。
(3)下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
II、某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g)  bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度可以增大活化分子百分数,从而使反应速率增大
B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能
C.在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度
D.研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:实验题
实验室里需要纯净的溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
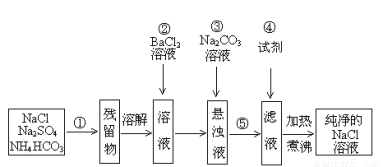
根据以上设计方案,回答下列问题:
(1)操作①和⑤的方法分别是 、 ;
(2)操作②是否可改为加硝酸钡溶液?为什么? ,(填是或否)理由: 。
(3)操作②后,如何判断SO42-已除尽,方法是 。
(4)操作③的目的是 ;
(5)操作④加的试剂是 ;发生反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.在稀溶液中,H+(aq)+ OH?(aq)=H2O(l);△H=﹣57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
C.由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨比金刚石稳定
D.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第四次月考理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
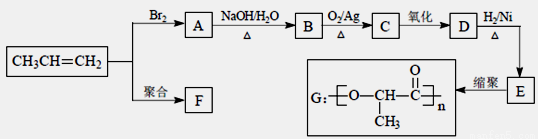
(1)聚合物F的结构简式是______________________。
(2)D的结构简式是 。
(3)B转化为C的化学方程式是 。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是 __________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com