
| A、0.6mol NO |
| B、0.3mol NO2 |
| C、0.3molNO 0.3molNO2 |
| D、0.2molNO2 0.2molN2O4 |
| 20.2g-10g |
| 17g/mol |
| 20.2g-10g |
| 17g/mol |


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= |
| 2 | 20.00 | 6.00 | 26.00 | |
| 3 | 20.00 | 4.50 | 24.50 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者都能产生丁达尔现象 |
| B、两者都不能产生丁达尔现象 |
| C、NaCl溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象 |
| D、NaCl溶液不能产生丁达尔效应,Fe(OH)3胶体能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
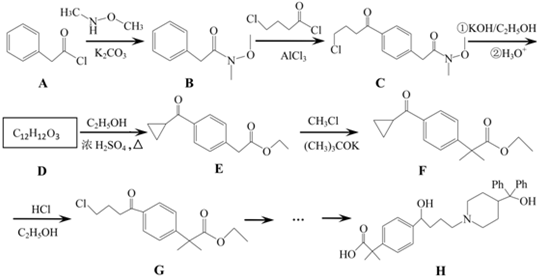
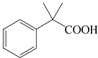 是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2
是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2| Br |
| NaOH溶液 |
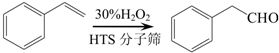 →
→查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| C、常温下,金属铁遇浓硫酸时会在表面生成致密的氧化膜而发生钝化 |
| D、50mL 18mol?L-1硫酸中加入足量的铜粉反应放出二氧化硫气体少于10.08L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al起始反应的离子方程式为2Al+6H+=2Al3++3H2↑ |
| B、滤液I中一定含有Cu2+、Al3+;一定含有Fe2+和Fe3+中的一种或两种 |
| C、滤渣I的主要成分是Au与Pt,由此可以回收贵重的金属 |
| D、加入稀硫酸可以提高硝酸的利用率,使硝酸根离子完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (苯胺,易被氧化)
(苯胺,易被氧化)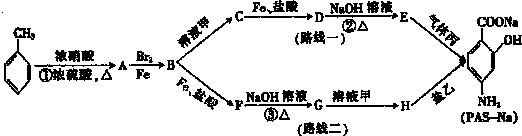
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容及现象 | 实验结论 | |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出 | 两份蛋白质溶液均发生变性 |
| B | 向某溶液中滴加KSCN溶液,无明显现象,滴加氯水后,溶液变红 | 说明溶液中含有Fe2- |
| C | 向BaSO4悬浊液中加入饱和Na2CO3溶液,发现有BaCO3生成 | 说明Ksp(BaSO4)Ksp(BaCO4) |
| D | 将苯滴入溴水中,震荡,静置,溴水层褪色 | 溴和苯发生加成反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NA |
| B、2L 0.5mol/L BaCl2溶液中,阳离子所带电荷数为 NA |
| C、常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3 NA个SO2分子 |
| D、42g丙烯气体中,含有的σ键数目为8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com