
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两种化合物中R的化合价相同
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
已知2H(g)+Y(g)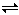 2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
A.0.2mol B.0.5 mol C.0.6 mol D.0.8 mol
查看答案和解析>>
科目:高中化学 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:推断题
分(I)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素.F与G位置相邻.G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)A与D形成的18电子的化合物与FD2化合生成一种强酸,写出该强酸酸式钠盐水溶液的电离方程式为:________________。
(2)用电子式表示化合物E2D的形成过程:________________。
(3)在l0lkPa、25℃下,14g气态B2A4在D2中完全燃烧,放出QkJ热量,则B2A4的燃烧热的热化学方程式为:________________。
(Ⅱ)A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)
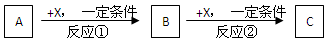
试同答:
(4)若X是强氧化性单质,则A不可能是___________。
a.H,S b. NH3c.Na d.Zn e.CH3CH2OH
(5)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C的化学式为________________。
(6)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:填空题
元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: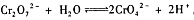 。在实际工业生产中,加入沉淀剂BaCl
。在实际工业生产中,加入沉淀剂BaCl 2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
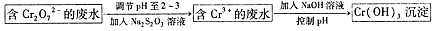
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路 通过的电子的物质的量为 mol
通过的电子的物质的量为 mol
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
取一定质量的均匀固体混合物Cu、CuO和Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20 g,另一份中加入500 mL稀硝酸(其还原产物为NO),固体恰好完全溶解,且同时收集到标准状况下NO气体4.48 L,则所用硝酸的物质的量浓度为( )
A.2.4 mol/L B.1.4 mol/L C.1.2 mol/L D.0.7 mol/L
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,设计正确且能达到实验目的的是 ( )
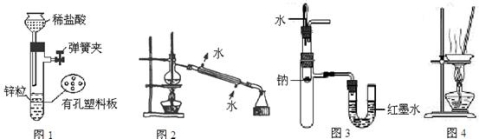
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3 溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源:2017届湖北省孝感市高三上第一次统考化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)和亚硫酸钠(NaClO2)均为高效漂白消毒剂。某化学兴趣小组同学对其制备展开研究。查阅资料已知:①二氧化氯(ClO2)与Cl2的性质具有一定相似性;
②NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
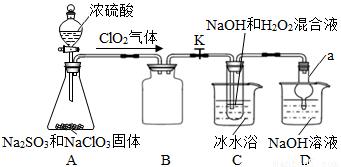
请回答下列问题:
(1)玻璃仪器a的名称___________;装置B的作用是___________________。
(2)装置C中制备NaClO2的化学方程式为________________________;通过调气阀K和浓硫酸的滴速控制气体流速,则应使进入C中气流速度较________(填“快”或“慢”);装置D的作用是_______________________________。
(3)从装置C反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;
③________________;④低于60℃干燥,得到成品。
(4)为测定某亚氯酸钠样品的纯度设计如下实验方案,并进行实验:
第一步:准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO +4I
+4I +4H+==2H2O+2I2+Cl
+4H+==2H2O+2I2+Cl )。将所得混合液配成250mL待测溶液。
)。将所得混合液配成250mL待测溶液。
第二步:移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol·L-1Na2S2O3标准溶液滴定,至滴定终点。重复2次,测得平均值为VmL(已知:I2+2S2O32-==2I +S4O52-)。
+S4O52-)。
①达到滴定终点时的现象为_______________________________。
②该样品中NaClO2的质量分数为_______________(用含m、c、V的代数式表示)。
③在滴定操作正确无误的情况下,此实验测得结果偏高,其原因用离子方程式表示为_______________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省孝感市高三上第一次统考化学试卷(解析版) 题型:选择题
下列物质分类正确的是( )
A.分子式为C15H22O5的青蒿素为高分子化合物
B.水玻璃、冰醋酸、四氯化碳均为电解质
C.化妆品、牙膏中的保湿剂甘油属于醇类
D.PX项目的主要产品对二甲苯属于饱和烃
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省苏州市高二上学期学业模拟三化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列判断正确的是
A.标准状况下,22.4 L苯中含有的分子数目为NA
B.25℃、101 kPa时,20 g SO3中含有的原子数目为NA
C.1 L 1 mol·L-1 MgCl2溶液中含有的氯离子数目为NA
D.16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com