
| A. | 石油分馏出的各馏分均是纯净物 | |
| B. | 纤维素、淀粉、蛋白质和天然油脂都属于天然高分子化合物 | |
| C. | 煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2 | |
| D. | 1mol蔗糖在酸性条件下水解得到2mol葡萄糖 |
分析 A.分馏石油得到的各个馏分为烃类物质的混合物;
B.相对分子质量在10000以上的有机化合物为高分子化合物,油脂不是高分子化合物;
C.煤与水蒸气的反应属于煤的气化,生成CO和H2;
D.蔗糖是二糖,在酸性条件下加热能发生水解得到葡萄糖和果糖.
解答 解:A.石油分馏的产物有:石油气、汽油、煤油、柴油、沥青等物质,各馏分均是混合物,故A错误;
B.淀粉、纤维素和蛋白质都属于天然高分子化合物,油脂相对分子质量较小,不属于高分子化合物,故B错误;
C.煤可与水蒸气反应制成水煤气:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,水煤气的主要成分为CO和H2,故C正确;
D. 1mol蔗糖在酸性条件下加热能发生水解得到1mol葡萄糖和1mol果糖,故D错误;
故选C.
点评 本题考查石油分馏、天然高分子化合物判别、水煤气的主要成分以及蔗糖的水解,注意把握物质的性质,注意相关基础知识的积累,题目难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油是多种碳氢化合物的混合物,可据各组分沸点不同进行分馏利用 | |
| B. | 煤的气化、液化是物理变化,煤的干馏是化学变化 | |
| C. | 天然气的主要成分是甲烷 | |
| D. | 酸雨形成的主要原因是含硫化石燃料的大量燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的.请回答下列问题: .
. .该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.该阳离子中存在的化学键有共价键,写出该阳离子与F氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
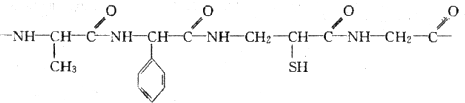
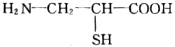
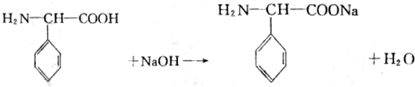
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | R |
| A. | 原子半径的大小顺序:Z>X>Y | |
| B. | W、Y的气态氢化物的稳定性:W>Y | |
| C. | Z单质一定是金属铝 | |
| D. | W、R的最高价氧化物对应水化物的酸性:W>R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇苯酚显紫色的溶液:Na+、Al3+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液:K+、Mg2+、SO42-、NO3- | |
| C. | 加入淀粉碘化钾溶液变蓝色的溶液:Na+、CO32-、HSO3-、OH- | |
| D. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com