
| A. | 乙烯与溴水(加成反应) | |
| B. | 苯与浓硝酸(取代反应) | |
| C. | 乙醇与乙酸(酯化反应) | |
| D. | 乙醇与氧气在铜作催化剂下反应(取代反应) |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
氧化反应:有机反应中得氧或失氢的反应为氧化反应,结合物质的性质以及官能团的转化解答该题.
解答 解:A.乙烯和溴水的反应生成二溴乙烷,C=C键生成C-C键,属于加成反应,故A正确;
B.苯和浓硝酸发生的硝化反应生成硝基苯,硝基替代苯环上的氢原子,属于取代反应,故B正确;
C.乙醇与乙酸发生反应生成乙酸乙酯,乙酸乙酯含有酯基,该反应为酯化反应,也为取代反应,故C正确;
D.乙醇与氧气在铜作催化剂下反应生成乙醛,为氧化反应,故D错误;
故选D.
点评 本题考查有机物结构与性质,为高频考点,侧重于有机反应类型的判断,题目难度不大,注意掌握常见有机反应的概念判断方法,试题培养了学生灵活应用所学知识的能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 1溴丙烷与NaOH的醇溶液共热 | B. | 乙醛与H2加成 | ||
| C. | 乙醇与浓H2SO4共热到140℃ | D. | 1-溴丙烷与NaOH的水溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
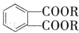 (代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示: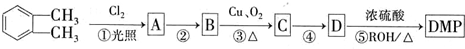
 .
.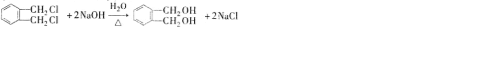 .
. .
. 制备DMP的另一种途径:
制备DMP的另一种途径: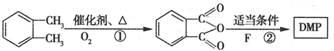
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明反应:2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态 | |
| B. | 若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 | |
| C. | 步骤②中,若要还原1 mol Cr2O72-离子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是( )
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是( )| A. | 甲醛水溶液可作为食物防腐剂 | |
| B. | 该反应类型为缩聚反应 | |
| C. | 三聚甲醛分子中既含σ键又含п键 | |
| D. | 常温下,9g三聚甲醛中含1.806×1023个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
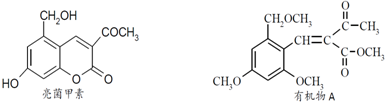


 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com