
| �¶�/K | ��ӦI | ��ӦII | ��֪�� K2��K1��K2�䣾K1�� |
| 298 | K1 | K2 | |
| 398 | K1�� | K2�� |
���� ����֪����ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����H1
��ӦII��2NO��g��+O2��g��?2NO2��g����H2
���ݸ�˹���ɣ���-���3�ɵã�4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l������Ϊ��H3=��H1-3��H2��
��֪K1��K1�䣬˵����ӦI�����¶�ƽ�������ƶ�����Ӧ��Ϊ���ȷ�Ӧ�����H1��0����K2��K2�䣬˵����Ӧ�������¶�ƽ�������ƶ�����Ӧ��Ϊ���ȷ�Ӧ�����H2��0����ϡ�H3=��H1-3��H2����|��H1|=2|��H2|���жϣ�
��A����ӦI����λʱ����H-O����N-H�����ѵ���Ŀ��ȣ�˵����λʱ������NH3�����ʵ���������H2O�����ʵ�����ȣ�
B���ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵���¶Ȳ��ٸı䣻
C��ѹǿ���ı����Ӱٷ�����
D����������������ʱ���ٳ���NO2���壬�൱������ѹǿ��
��� �⣺����֪����ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����H1
��ӦII��2NO��g��+O2��g��?2NO2��g����H2
���ݸ�˹���ɣ���-���3�ɵã�4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l������Ϊ��H3=��H1-3��H2���Ȼ�ѧ����ʽΪ4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l����H=��H1-3��H2��
��֪K1��K1�䣬˵����ӦI�����¶�ƽ�������ƶ�����Ӧ��Ϊ���ȷ�Ӧ�����H1��0����K2��K2�䣬˵����Ӧ�������¶�ƽ�������ƶ�����Ӧ��Ϊ���ȷ�Ӧ�����H2��0����֪|��H1|=2|��H2|�����ԡ�H3=��H1-3��H2=|��H2|��0������Ӧ��Ϊ���ȷ�Ӧ��
�ʴ�Ϊ��4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l����H=��H1-3��H2�����ȣ�
��A����ӦI����λʱ����H-O����N-H�����ѵ���Ŀ��ȣ�˵����λʱ������NH3�����ʵ���������H2O�����ʵ�����ȣ�˵�����淴Ӧ������ȣ��ﵽƽ��״̬����A��ȷ��
B���ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵���¶Ȳ��ٸı䣬�ﵽƽ��״̬����B��ȷ��
C��ѹǿ���ı����Ӱٷ�������C����
D����������������ʱ���ٳ���NO2���壬�൱������ѹǿ����ƽ�������ƶ���NO2����������D��ȷ��
�ʴ�Ϊ��C��
���� ���⿼���Ϊ�ۺϣ��漰��ѧƽ��Ӱ�����ء�ƽ��״̬���жϡ���Ӧ�ȼ���ȣ�Ϊ�߿��������ͺ�Ƶ���㣬��Ŀ�Ѷ��еȣ������ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ��������


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3������ | B�� | NH3�������� | C�� | NO�ǻ�ԭ���� | D�� | H2O���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
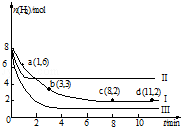 һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������
һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������| A�� | �÷�Ӧ��0��8 min��CO2��ƽ����Ӧ������ 0.375 mol•L-1•min-1 | |
| B�� | ����ʼʱ�����������г���3 mol CO2��4 mol H2����ƽ��ʱH2�������������20% | |
| C�� | ����ʼʱ�����������г���4 mol CO2��2 mol H2��2 mol CH3OH��1mol H2O��g�������ʱ��Ӧ������Ӧ������� | |
| D�� | �ı������õ����ߢ������ߢ�ı�������ֱ��������¶ȡ����뺤�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
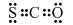 ������CO��g����Sx��s����Ӧ���Ȼ�ѧ����ʽ��xCOS��g��=xCO��g��+Sx��s����H=0.5x��b-a��kJ/mol
������CO��g����Sx��s����Ӧ���Ȼ�ѧ����ʽ��xCOS��g��=xCO��g��+Sx��s����H=0.5x��b-a��kJ/mol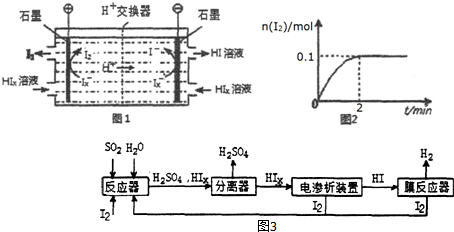
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| t/% | 0 | 2 | 4 | 6 | 8 |
| n��Cl2��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A�� | ��Ӧ��ǰ2s��ƽ������v��CO��=0.080mol/L/s | |
| B�� | ���������������䣬�����¶ȣ�ƽ��ʱc��Cl2��=0.11mol/L | |
| C�� | T Kʱ��ʼ�������г���0.9molCOCl2/0.10molCO����Ӧ�ﵽƽ��ǰv��������v���棩 | |
| D�� | T Kʱ��ʼ�������г���1.0molCl2��0.9molCO���ﵽƽ��ʱ��Cl2��ת����С��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״�����Ҫ�Ļ���ԭ�ϣ���̬�״��������Ʊ���ȩת����������ϵ��ͼ��ʾ��
�״�����Ҫ�Ļ���ԭ�ϣ���̬�״��������Ʊ���ȩת����������ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
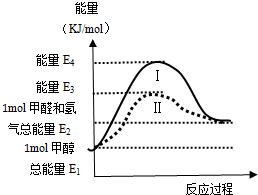
 SO2��NOx�ڻ�ѧ��ҵ������Ҫ��;��Ҳ�Ǵ�����Ⱦ����Ҫ��Դ�����������ò��أ�Ԥ�������������ǵ�ǰ��ҵ�Ϻͻ������������о�����Ҫ����֮һ��
SO2��NOx�ڻ�ѧ��ҵ������Ҫ��;��Ҳ�Ǵ�����Ⱦ����Ҫ��Դ�����������ò��أ�Ԥ�������������ǵ�ǰ��ҵ�Ϻͻ������������о�����Ҫ����֮һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com