
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
| 离子共存问题.. | |
| 专题: | 离子反应专题. |
| 分析: | A.酸性条件下NO3﹣具有强氧化性,具有还原性的离子不能大量共存; B.甲基橙呈红色的溶液呈酸性; C.c(H+)=10﹣12 mol•L﹣1的溶液呈碱性; D.加入苯酚显紫色的溶液,含有Fe3+,与Fe3+反应的离子不能大量共存. |
| 解答: | 解:A.酸性条件下NO3﹣具有强氧化性,具有还原性的Fe2+不能大量共存,故A错误; B.甲基橙呈红色的溶液呈酸性,酸性条件下AlO2﹣不能大量共存,且AlO2﹣与NH4+发生互促水解反应而不能大量共存,故B错误; C.c(H+)=10﹣12 mol•L﹣1的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故C正确; D.加入苯酚显紫色的溶液,含有Fe3+,I﹣与Fe3+发生氧化还原反应而不能大量共存,故D错误. 故选C. |
| 点评: | 本题考查离子共存问题,为高考高频考点和常见题型,侧重于学生的分析能力、审题能力的考查,注意把握常见离子的性质以及反应类型的判断,把握题给信息,难度不大. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
以下食品化学知识的叙述不正确的是( )
A.食盐可作调味剂,也可作食品防腐剂
B.新鲜蔬菜做熟后,所含维生素C会有损失
C.纤维素在人体内可水解为葡萄糖,故可做人类的营养物质
D.葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉 检验假红酒。
检验假红酒。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )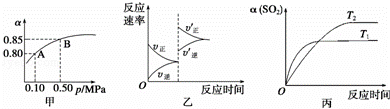
|
| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L |
|
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
|
| C. | 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
|
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验报告记录的实验现象正确的是( )
| 实验 |
| ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10﹣9 | 6.8×10﹣6 | 5.5×10﹣6 | 1.8×10﹣11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 不能 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 CaCO3\frac{\underline{\;高温\;}}{\;}CaO+CO2↑ .
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 可以 (填“可以”或“不可以”)得到Mg(OH)2.在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 能 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 Mg2++CO32﹣=MgCO3 MgCO3+2OH﹣=Mg(OH)2+CO32﹣ .(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10﹣3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为 10 .
查看答案和解析>>
科目:高中化学 来源: 题型:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为 三角锥形 ,F分子的电子式为 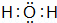 .
.
②反应 I 的化学方程式为 4NH3+5O2 4NO+6H2O .
4NO+6H2O .
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质.NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式 3NaN3=Na3N+4N2↑ .
④X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 6NOx+4xNH3=(3+2x)N2+6xH2O .
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g•mol﹣1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于 离子 晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为 4FeS2+11O2 2Fe2O3+8SO2 .
2Fe2O3+8SO2 .
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式 S2﹣+4ClO﹣=SO42﹣+4Cl﹣ .

查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO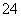 、CO
、CO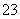
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO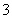 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH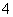 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO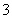
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是
| A | CH3CH3+Cl2 CH2=CH2+HCl | 均为取 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br‾=2Cl‾+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O+4NaOH+O2↑ Cl2+H2O=HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com