
【题目】高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知Na2FeO4在强碱性溶液中会析出沉淀。其生产工艺流程如图所示:
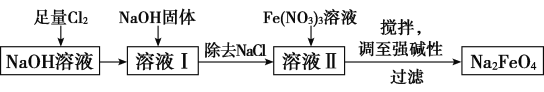
(1)写出向NaOH溶液中通入足量Cl2发生反应的离子方程式:_________________________。
(2)向溶液Ⅱ中加入Fe(NO3)3溶液发生反应,该反应的氧化剂是____________,每制得49.8 g Na2FeO4,理论上消耗氧化剂的物质的量为____________mol。
(3)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图甲所示。
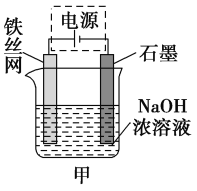
①电解过程中阳极的电极反应式为_______________________。
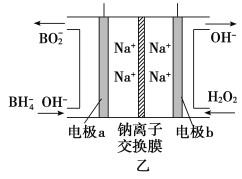
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图乙所示。工作过程中该电源的正极反应式为________________________,Na+由____________(填“a”或“b”,下同)极区移向____________极区。
【答案】(1)2OH-+Cl2=ClO-+Cl-+H2O
(2)NaClO(或次氯酸钠) 0.45
(3)①Fe+8OH--6e-=FeO![]() +4H2O
+4H2O
②H2O2+2e-=2OH- a b
【解析】(1)Cl2与NaOH溶液发生歧化反应生成NaCl、NaClO和H2O,由此可写出离子方程式。(2)结合(1)分析和流程知溶液Ⅱ中溶质主要是NaClO,因此加入Fe(NO3)3溶液后生成Na2FeO4,此反应中,氧化剂为NaClO,还原剂为Fe(NO3)3;利用得失电子守恒得:3NaClO~2Na2FeO4,由此可知生成49.8 g Na2FeO4消耗氧化剂的物质的量为![]() ×
×![]() =0.45 mol。(3)①电解时阳极Fe失电子被氧化为FeO
=0.45 mol。(3)①电解时阳极Fe失电子被氧化为FeO![]() ,结合电解质溶液为碱性可得,阳极电极反应式为Fe+8OH--6e-=FeO
,结合电解质溶液为碱性可得,阳极电极反应式为Fe+8OH--6e-=FeO![]() +4H2O;②电池工作时正极发生还原反应,结合图示原理知正极反应为H2O2得电子,被还原为OH-;电解质溶液中的阳离子(Na+)应由负极区(a极)移向正极区(b极)。
+4H2O;②电池工作时正极发生还原反应,结合图示原理知正极反应为H2O2得电子,被还原为OH-;电解质溶液中的阳离子(Na+)应由负极区(a极)移向正极区(b极)。


科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42﹣和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是( )
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.④⑤②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g) ![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
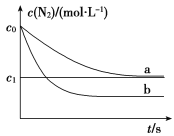
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素是参与生物生长发育和新陈代谢所必须的物质,中学生每天需要补充一定量的维生素C。下列食品中维生素C含量最丰富的是
A.植物油 B.馒头 C.牛肉 D.橙子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:4L(g)![]() 2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指

A. 气体混合物的平均相对分子质量 B. 气体混合物的总物质的量浓度
C. L在气体混合物的体积分数 D. 气体混合物的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关维生素的说法中不正确的是
A.维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物
B.维生素C溶于水,溶液显酸性
C.生吃新鲜蔬菜要比熟吃时维生素C的损失小
D.含维生素C能使蓝色的碘的淀粉溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,2 mol X2(气)和6 mol Y2(气)化合生成4 mol的气体化合物,则该气体化合物的化学式为
A.XY3 B.XY C.X3Y D.X2Y3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com