
| A. | KClO3中的氯元素被氧化 | |
| B. | Cl2既是氧化剂,又是还原剂 | |
| C. | 还原剂是HCl | |
| D. | 每生成1mol Cl2转移电子的物质的量为6mol |
分析 KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3H2O+3Cl2↑中,Cl元素的化合价由+5价 降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:A.KClO3中的氯元素化合价降低,得到电子被还原,故A错误;
B.氯气为生成物,为氧化产物和还原产物,故B错误;
C.Cl元素的化合价升高,则HCl为还原剂,故C正确;
D.由反应可知,生成3mol气体时转移5mol电子,则每生成1mol Cl2转移电子的物质的量为$\frac{5}{3}$mol,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
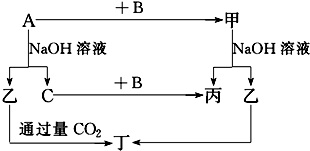
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的N4、N5分子其原子数之比为5:4 | |
| B. | N5、N4与N2互为同素异形体 | |
| C. | N4、N5均属于新型的化合物 | |
| D. | N5的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
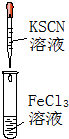 | 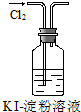 | 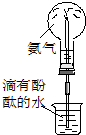 | 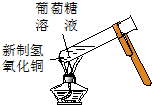 |
| ① | ② | ③ | ④ |
| A. | 实验①试管中混合溶液中出现红色沉淀 | |
| B. | 实验②中溶液变黄色 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
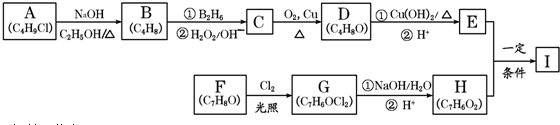
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非电解质溶于水得到的溶液 | |
| B. | [H+]、[OH-]均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
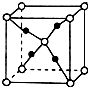 X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com