
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
分析 A.HCO3-水解生成碳酸和氢氧根离子,题干给出的是电离方程式;
B.铜为阳极是活性电极,参与反应;
C.氯化银与氨水发生络合反应生成可溶性络合物;
D.将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体,不能用沉淀符合,反应用等号.
解答 解:A.HCO3-水解的离子方程式:HCO3-+H2O?H2CO3+OH-,故A错误;
B.用铜为电极电解饱和食盐水,离子方程式:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑,故B错误;
C.氨水溶解氯化银固体,离子方程式:AgCl+2 NH3•H2O═[Ag(NH3)2]++Cl-+2H2O,故C正确;
D.将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?=Fe(OH)3(胶体)+3H+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意胶体不是沉淀,题目难度不大.


科目:高中化学 来源: 题型:填空题
 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 原子团 | -CH2- | 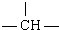 | -CH3 | -NH2 | -OH |
| 个数 | n | m | a | 2 | X |
| A. | m-a | B. | n+m+a | C. | m+2n-a | D. | 2n+3m-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 常温下,c(H+)/c(OH-)=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 水电离出的c(H+)=10-12mol•L-1的溶液:K+、Na+、CO32-、Br- | |
| D. | 含有0.1mol•LHCO3-的溶液:Na+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/s | 0 | 3 | 6 | 12 | 24 |
| n(CO2)/mol | 0 | 0.6 | 0.96 | 1.5 | 1.5 |
| A. | 反应在0~3s内的平均速率v(H2O)=0.12mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(CO2)=0.76mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,若起始时向容器中充入4.0molH2O和2.0molCO2、2.0molH2,与原平衡相比,达到平衡时,容器内压强增大 | |
| D. | 在T温度下,起始时向容器中充入2.0molH2O、1.0molCO2和1.0molH2,达到平衡时,CO2的转化率等于25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最差的是Y | |
| B. | X元素形成的单核阴离子还原性强于Y | |
| C. | Z元素氧化物对应水化物的酸性强于Y | |
| D. | Y元素单质在化学反应中只表现出氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定存在Br-、CO32- | B. | 溶液中一定存在NH4+ | ||
| C. | 溶液中一定不存在Fe2+、I-、SO32- | D. | 溶液中可能存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④ | C. | ①③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com