
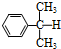
 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: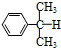 +O→
+O→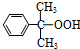 (异丙苯过氧氢)
(异丙苯过氧氢)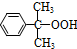 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$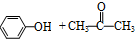 (丙嗣)
(丙嗣)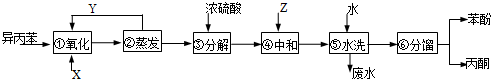
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
 ,产品T是丙酮,
,产品T是丙酮, ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.分析 用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器①中发生氧化反应生成 ,在②中蒸发分离出
,在②中蒸发分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在③中在浓硫酸作催化剂条件下分解得到
在③中在浓硫酸作催化剂条件下分解得到 、
、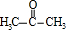 ,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,据此答题.
,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,据此答题.
解答 解:用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器①中发生氧化反应生成 ,在②中蒸发分离出
,在②中蒸发分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在③中在浓硫酸作催化剂条件下分解得到
在③中在浓硫酸作催化剂条件下分解得到 、
、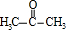 ,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,
,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,
(1)根据上面的分析可知,X物质是 氧气(或空气);Y物质是 异丙苯,
故答案为:氧气(或空气);异丙苯;
(2) 在③中在浓硫酸作催化剂条件下分解得到
在③中在浓硫酸作催化剂条件下分解得到 、
、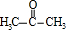 ,所以浓硫酸的作用是 催化剂,其优点是用量少,可能的缺点是 浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等),
,所以浓硫酸的作用是 催化剂,其优点是用量少,可能的缺点是 浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等),
故答案为:催化剂;浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等);
(3)根据上面的分析可知,Z可以是碳酸氢钠,故选c;
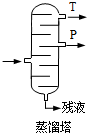
(4)步骤⑥分馏中,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚,
故答案为:丙酮; 丙酮的沸点低;
(5)苯酚与浓溴水反应的化学方程式为 ,由于溴易挥发,所以第1加盐酸、第②步加KI溶液,要迅速盖好盖子,防止溴挥发,
,由于溴易挥发,所以第1加盐酸、第②步加KI溶液,要迅速盖好盖子,防止溴挥发,
故答案为: ;溴易挥发;
;溴易挥发;
(6)溶液中有淀粉,当达到滴定终点时,碘反应完全,所以滴定终点的现象是 由蓝色变为无色(或白色浑浊)且半分钟内不变色;
20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,根据方程式BrO3-+5Br-+6H+→3Br2+3H2O可知,生成的溴的物质的量为3×0.0100mol/L×0.02L=6×10-4 mol,根据反应I2+2Na2S2O3→2NaI+Na2S4O6可知,由溴与碘化钾反应生成的碘的物质的量为0.0250mol/L×0.02248L×$\frac{1}{2}$=2.81×10-4 mol,所以与苯酚反应的溴的物质的量为6×10-4 mol-2.81×10-4 mol=3.19×10-4 mol,根据反应 可知,苯酚的物质的量为3.19×10-4 mol×$\frac{1}{3}$=1.06×10-4 mol,所以废水中苯酚的浓度是$\frac{1.06×1{0}^{-4}mol}{0.02L}$=0.0053mol/L,
可知,苯酚的物质的量为3.19×10-4 mol×$\frac{1}{3}$=1.06×10-4 mol,所以废水中苯酚的浓度是$\frac{1.06×1{0}^{-4}mol}{0.02L}$=0.0053mol/L,
故答案为:由蓝色变为无色(或白色浑浊)且半分钟内不变色;0.0053.
点评 本题考查有机物的制备实验方案,涉及对化学工艺流程、装置及试剂的分析评价等,关键是根据实验目的与给予的反应信息理解工艺流程原理,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-→Al(OH)3↓ |
| D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素和淀粉遇碘水均显蓝色 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 乙酸乙酯和食用植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 编号 | 溶液X | 实验现象 |
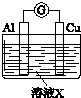 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
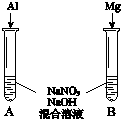 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com