
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
分析 (1)已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
②×2-①+③×4得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)根据盖斯定律计算反应的焓变;
(2)根据化学平衡的特征“等”、“定”及由此衍生的一些量来判断平衡;
(3)根据v=$\frac{△c}{△t}$计算反应速率,根据转化率等于变化量和初始量的比值来计算;平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$,根据影响化学反应速率和平衡移动的因素来回答;
(4)根据Qc可K的关系确定反应的移动方向,进而确定正逆反应速率的大小.
解答 解:(1)已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
②×2-①+③×4得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)根据盖斯定律,△H=2×(-534.0kJ/mol)-67.7kJ/mol+4×(-44kJ/mol)=-1311.7kJ/mol;
故答案为:-1311.7;
(2)a.混合气体密度等于质量和体积的比值,但是密度始终保持不变,所以不一定是平衡状态,故错误;
b.混合气体颜色保持不变,说明各组分的浓度不随着时间的改变而改变,达到了平衡,故正确;
c.将N2H4与N02以体积比1:1置于密闭容器中,N2H4比与NO2体积比始终保持不变,此时不一定是平衡状态,故错误;
d.反应前后气体的系数和不变化,所以体系压强保持不变,说明反应达到了平衡,故正确;
故选ac;
(3)前2min内NO2的平均反应速率为$\frac{\frac{0.8mol-0.6mol}{10L}}{2min}$=0.01mol/(L•min),平衡时N02的转化率$\frac{1.6-1.2}{1.6}$×100%=25%,(2)中反应平衡常数表达式为K=$\frac{c{\;}^{3}(N{\;}_{2})}{c{\;}^{2}(N{\;}_{2}H{\;}_{4})•c{\;}^{2}(NO{\;}_{2})}$,计算该温度下反应的平衡常数K=$\frac{0.6{\;}^{3}}{1.2{\;}^{2}×0.4{\;}^{2}}$=0.9375,反应在第6min时改变了条件,此时各组分的浓度仍然保持不变,但是到了10min时,反应物的浓度增加,产物浓度减小,所以改变的条件可能是升高温度或是扩大容器容积,平衡逆向移动的结果,故选bc;
故答案为:0.01mol/(L•min);25%;K=$\frac{c{\;}^{3}(N{\;}_{2})}{c{\;}^{2}(N{\;}_{2}H{\;}_{4})•c{\;}^{2}(NO{\;}_{2})}$;0.9375;bc;
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol.L-1,此时Qc=$\frac{0.1{\;}^{3}}{0.1{\;}^{2}×0.1{\;}^{2}}$=10<K,所以v正>v逆,故答案为:>.
点评 本题考查学生盖斯定律的应用、反应速率的计算以及化学平衡的有关计算等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是酸雨的主要成分 | |
| B. | 氢气是一种理想的清洁燃料 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 氯化铁溶液可用于制作印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
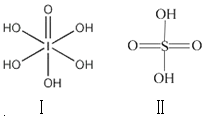 已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).
已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL量筒量取8.6mL浓硫酸 | |
| B. | 用托盘天平称量8.75g食盐 | |
| C. | 用500mL的容量瓶来配制需要的450mL溶液 | |
| D. | 用胶头滴管取5mL的某溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
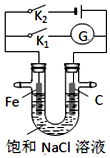
| A. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| B. | K1闭合,铁棒上发生的反应为2H++2e→H2↑ | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com