
| A. | 1L该溶液中含KNO3101g | |
| B. | 100 mL该溶液中含KNO3 0.01mol | |
| C. | 从1L该溶液中取出500 mL后,剩余溶液的浓度为0.05 mol/L | |
| D. | 1L水中溶解0.1 mol KNO3,即可配得0.1 mol/L KNO3溶液 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{58}^{80}$Ce | B. | ${\;}_{58}^{138}$Ce | C. | ${\;}_{80}^{58}$Ce | D. | ${\;}_{80}^{138}$Ce |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用金属钠或金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
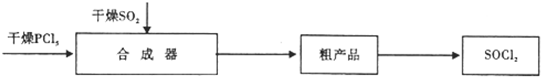
| 实验步骤 | 预期现象和结论 |
| 步骤1取少量吸收液于试管中滴加3moL.L-1H2SO4,至溶液呈酸性,然后将所得溶液分置于A、B试管中. | 无明显现象 |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后褪色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,否则无 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
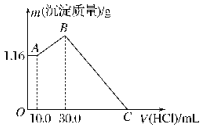 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.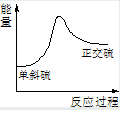
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 4.7 | 3.4 |
| 沉淀完全的pH | 3.2 | 6.7 | 4.7 |
| A. | 该温度下Ksp[Fe(OH)3]=1×10-14.6 | |
| B. | W主要含有 Cu(OH)2和Al(OH)3 | |
| C. | 溶液X中一定含有Cu2+、Fe3+和SO42- | |
| D. | 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com