
【题目】Se是人体必需微量元素,下列有关 ![]() Se和
Se和 ![]() Se的说法正确的是( )
Se的说法正确的是( )
A.![]() ?Se 和
?Se 和 ![]() Se所含电子数不同
Se所含电子数不同
B.![]() Se和
Se和 ![]() Se都含有34个中子
Se都含有34个中子
C.![]() Se和
Se和 ![]() Se分别含有44和46个质
Se分别含有44和46个质
D.![]() Se和
Se和 ![]() Se互为同位素
Se互为同位素
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
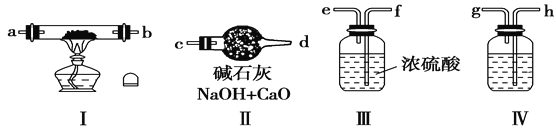
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为____________;相同条件下体积之比为________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g 该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。RO2的化学式为______。
(3)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O,恰好达到饱和,该溶液的密度为1.60 g/cm3,则该溶液中CuSO4的物质的量浓度为____________,从中取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O = CO2 + 2HCl + Pd↓
(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是_ 。
(2)装置B的作用是_ 。
(3)装置C、D中所盛试剂分别为_ ___ 、_ ___,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为_ 。
(4)该装置的缺点是_ 。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC。取18 g SiO2和8.4 g焦炭充分反应后收集到标准状况下的气体13.44 L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为_ 。
(6)设计实验证明碳酸的酸性比硅酸的强:_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
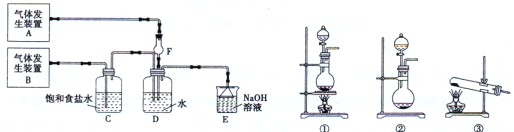
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是 ;气体发生装置B应选择①、②、③三种装置中的 (选填序号)。
(2)D装置中主要反应的离子方程式为: 。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有 (试剂名称,下同)的试管中,再加入产生的现象是 ,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有 的试管内,产生的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的使用正确的是( )
A.Cl2通入石灰乳中制漂白粉的离子方程式:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.利用泡沫灭火器灭火时发生的反应:2Al3++CO32﹣+3H2O═2Al(OH)3↓+CO2↑
C.已知离子的还原性:Sn2+>Fe2+ , 则可推测在溶液中能发生如下反应:Sn4++2Fe2+═2Fe3++Sn2+
D.298 K时,已知12g石墨完全燃烧生成CO2(g)放出393.5kJ热量,1mol CO完全燃烧放出283.5kJ热量,则一定有:C(s,石墨)+ ![]() O2(g)═CO(g)△H=﹣110 kJ?mol﹣1
O2(g)═CO(g)△H=﹣110 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | F | Na | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)非金属性最强的元素是;
(2)Ne 原子结构示意图为;
(3)C 与N 中,原子半径较小的是;
(4)氯水具有漂白作用,是由于其中含有(填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);
(6)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的名称);
(7)如图为某有机物的球棍模型(其中 ![]() 代表氢原子代表
代表氢原子代表 ![]() 碳原子),
碳原子), 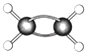 该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是无色有刺激性气味的液体,熔点为-54.1℃,沸点为69℃,在潮湿空气中易“发烟”。实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(部分夹持装置已省略):
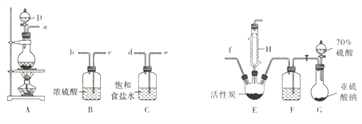
回答下列问题:
(1)实验室制备干燥纯净的氯气可以用A、B、C装置来完成,请连接装置接口:a→___,____→___,______→f(按气流流动方尚;用小写学母表示)。
(2)实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________。
(3)装置C的作用是____________;装置B和F中浓硫酸起到的作用是①____________;②可观察到____________(填现象)来反映通入气体的速率,利用反应液滴加的快慢对气体通入速率加以控制,从而使通入反应器的SO2和Cl2达到最佳反应比例。
(4)该装置存在明显的缺陷,请指出:________________。
(5)已知该法合成硫酰氯为可逆反应,每生成2.7g硫酰氯放出热量1940J,写出该反应的热化学方程式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:
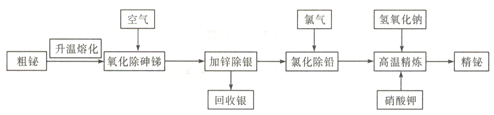
已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com