
(9分)硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图所示
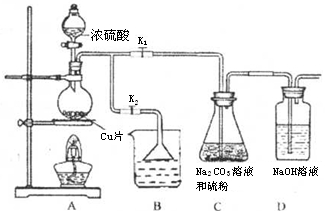
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下:
步骤1:如图连接好装置后, ,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱检查装置A、C、D气密性。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。装置B中的药品可选用下列物质中的。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHSO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2 ,关闭K1即停止C中的反应,停止加热。“当C中溶液的pH接近7时即停止C中的反应”的原因是______________________(用离子方程式表示)。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式_________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL ,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液V mL,将其分成4等份,加入淀粉溶液作指示剂,用0.0010 mol·L-1 的Na2S2O3溶液进行滴定,相关数据记录如下表所示:
编号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
①Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O ;②I2 + 2S2O32- = 2I- + S4O64-。
则判断达到滴定终点的现象是__________________。
废水中Ba2+的物质的量浓度为__________________。
科目:高中化学 来源:2015-2016学年甘肃省高一上段中考试化学试卷(解析版) 题型:选择题
某溶液中含有较大量的Cl﹣、CO32-、OH﹣等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
B.①②③②④ D.④②③②①
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
在同温同压下,下列各组热化学方程式中Q2> Q1的是
A.H2(g)+Cl2(g)=2HCl(g) △H= -Q1;
1/2H2(g)+1/2Cl2(g)=HCl(g) △H= -Q2
B.C(s)+1/2O2(g)=CO (g) △H= -Q1;
C(s)+ O2(g)=CO2(g) △H= -Q2
C.2H2(g)+O2(g)=2H2O(l) △H= -Q1;
2H2(g)+O2(g)=2H2O(g) △H= -Q2
D.S(g)+O2(g)=SO2(g) △H= -Q1;
S(s)+O2(g)=SO2(g) △H= -Q2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一上学期10月月考化学试卷(解析版) 题型:选择题
苯作萃取剂,并用分液漏斗萃取溴水中的溴单质的实验,下列说法正确的是
A.不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小
B.静置分层后有色层在下层,水层几乎无色
C.分液漏斗使用前应当用蒸馏水检验是否漏液
D.振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:填空题
(14分)元素周期表的用途广泛。
(1)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 沸点 |
K+_____S2- | N____O | 硫酸_____高氯酸 | HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液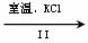 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
查看答案和解析>>
科目:高中化学 来源:2016届广东省揭阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
如图进行实验,试管中现象对应的离子方程式不正确的是
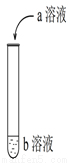
选项 | a | b | 试管中现象 | 离子方程式 |
A | 硫酸 | KI淀粉 | 在空气中放置一段时间后溶液呈蓝色 | 4H++ 4I- + O2=2I2 + 2H2O |
B | 稀盐酸 | Na2CO3 | 开始时无气泡,后来有气泡 | CO HCO |
C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++ SiO |
D | 硫酸 | 滴有酚酞Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2+ + OH- + H+ + SO BaSO4↓ + H2O |
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,Z是
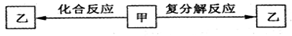
A.HCl B.FeCl2 C.KOH D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:推断题
【有机化学基础】(1 5分)化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环且苯环上有2种化学环境氢。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8%,含氢7.0%,核磁共振氢谱显示只有一个峰。
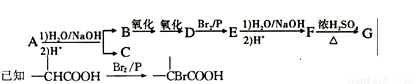
请回答下列问题:
(1)写出G的分子式: 。
(2)写出A的结构简式:____ 。
(3)写出F—→G反应的化学方程式:____ ,该反应属于 (填反应类型)。
(4)写出满足下列条件的C的所有同分异构体的结构简式: 。
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇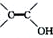 结构。
结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式
(只要写出1种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com