
”¾ĢāÄæ”æÉś²ś”¢Éś»īÖŠ²śÉśµÄ·ĻĖ®”¢·ĻĘųŹĒ»·¾³ĪŪČ¾µÄÖŲŅŖŌ“Ķ·”£ŌŚ»·¾³ÖĪĄķ·½ĆęČĖĆĒæÉĄūÓĆI2O5ŗĶNa2SO3µČ»Æ¹¤²śĘ·ŹµĻÖ¶Ō·ĻĖ®ŗĶ·ĻĘųµÄÖĪĄķ”£
£Ø1£©ĄūÓĆI2O5µÄŃõ»ÆŠŌ“¦Ąķ·ĻĘųH2S£¬µĆµ½S”¢I2Į½ÖÖµ„ÖŹ£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ________________”£
£Ø2£©ĄūÓĆI2O5Ņ²æÉĻū³żCOµÄĪŪČ¾£¬Ęä·“Ó¦ŌĄķĪŖI2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ¦¤H”£ŅŃÖŖŌŚ²»Ķ¬ĪĀ¶Č£ØT1”¢T2£©ĻĀ£¬Ļņ×°ÓŠ×ćĮæI2O5¹ĢĢåµÄ2 LŗćČŻĆܱÕČŻĘ÷ÖŠĶØČė2 mol CO£¬²āµĆCO2ĘųĢåµÄĢå»ż·ÖŹż¦Õ(CO2)Ėꏱ¼ätµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£
5CO2(g)+I2(s) ¦¤H”£ŅŃÖŖŌŚ²»Ķ¬ĪĀ¶Č£ØT1”¢T2£©ĻĀ£¬Ļņ×°ÓŠ×ćĮæI2O5¹ĢĢåµÄ2 LŗćČŻĆܱÕČŻĘ÷ÖŠĶØČė2 mol CO£¬²āµĆCO2ĘųĢåµÄĢå»ż·ÖŹż¦Õ(CO2)Ėꏱ¼ätµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£

¢ŁĪĀ¶ČĪŖT2Ź±£¬0”«2 min ÄŚ£¬CO2µÄĘ½¾ł·“Ó¦ĖŁĀŹ ¦Ō(CO2)=______________”£
¢ŚbµćŹ±COµÄ×Ŗ»ÆĀŹĪŖ_______£¬»Æѧ·“Ó¦µÄĘ½ŗā³£ŹżK=_____£ØĢī±ķ“ļŹ½£©”£
¢Ū·“Ó¦£ŗI2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)µÄ¦¤H______0£ØĢī”°>”±”°<”±»ņ”°=”±£©”£
5CO2(g)+I2(s)µÄ¦¤H______0£ØĢī”°>”±”°<”±»ņ”°=”±£©”£
¢ÜÉĻŹö·“Ó¦ŌŚT1ĻĀ“ļµ½Ę½ŗāŹ±£¬ŌŁĻņČŻĘ÷ÖŠ³äČėĪļÖŹµÄĮæ¾łĪŖ2 molµÄCOŗĶCO2ĘųĢ壬Ōņ»ÆŃ§Ę½ŗā________£ØĢī”°Ļņ×ó”± ”°ĻņÓŅ”±»ņ”°²»”±£©ŅĘ¶Æ”£
¢ŻĻĀĮŠĻÖĻó£¬æÉŅŌ±ķŹ¾ÉĻŹö·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ____________£ØĢī×ÖÄø£©”£
A£®ČŻĘ÷ÄŚµÄŃ¹Ēæ²»ŌŁ±ä»Æ B£®»ģŗĻĘųµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ
C£®»ģŗĻĘųµÄĆÜ¶Č²»ŌŁ±ä»Æ D£®µ„Ī»Ź±¼äÄŚĻūŗÄCOŗĶÉś³ÉCO2µÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć1
£Ø3£©Na2SO3¾ßÓŠ»¹ŌŠŌ£¬ĘäĖ®ČÜŅŗæÉŅŌĪüŹÕCl2(g)£¬¼õÉŁ»·¾³ĪŪČ¾”£
ŅŃÖŖ·“Ó¦£ŗ
¢ŁNa2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ¦¤H1=a kJ”¤mol1
Na2SO4(aq)+2HCl(aq) ¦¤H1=a kJ”¤mol1
¢ŚCl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ¦¤H2=b kJ”¤mol1
HCl(aq)+HClO(aq) ¦¤H2=b kJ”¤mol1
ŹŌŠ“³öNa2SO3(aq)ÓėHClO(aq)·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ________________________”£
”¾“š°ø”æ I2O5 + 5 H2S = 5S + I2 + 5H2O 0.15 mol”¤L-1 ”¤min-1 80% C5(CO2)/ C5(CO) < ĻņÓŅ BC Na2SO3(aq) + HClO(aq) ![]() Na2SO4(aq) + 2HCl(aq) ¦¤H=£Øa-b£©kJ”¤mol1
Na2SO4(aq) + 2HCl(aq) ¦¤H=£Øa-b£©kJ”¤mol1
”¾½āĪö”æ£Ø1£©ĄūÓĆI2O5µÄŃõ»ÆŠŌ“¦Ąķ·ĻĘųH2S£¬H2S±»Ńõ»ÆĪŖS”¢I2O5±»»¹ŌĪŖI2£¬øł¾Ż»ÆŗĻ¼ŪÉż½µ×ÜŹżĻąµČŅŌ¼°ÖŹĮæŹŲŗć¶ØĀÉ£¬æÉŅŌŠ“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖI2O5 + 5 H2S = 5S + I2 + 5H2O”£
£Ø2£©øĆ·“Ó¦ŹĒŅ»øöĘųĢå·Ö×ÓŹż±£³Ö²»±äµÄ·“Ó¦£¬ĖłŅŌ·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ±£³Ö²»±ä”£ÓÉĶ¼ĻńæÉÖŖ£¬·“Ó¦ŌŚT2Ź±ĻČ“ļµ½Ę½ŗāדĢ¬£¬ĖłŅŌT1<T2£¬ĪĀ¶ČT1ÓÉÉżøßµ½T2ŗ󣬦Õ(CO2)¼õŠ”£¬ĖµĆ÷Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦”£
¢ŁĪĀ¶ČĪŖT2Ź±£¬0”«2 min ÄŚ£¬¦Õ(CO2)ÓÉ0Éżøßµ½0.3£¬ŌņCO2µÄ±ä»ÆĮæĪŖ2mol![]() £¬CO2µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō(CO2)=
£¬CO2µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō(CO2)= ![]() 0.15 mol”¤L-1 ”¤min-1”£
0.15 mol”¤L-1 ”¤min-1”£
¢ŚbµćŹ±¦Õ(CO2)=0.8£¬COµÄ±ä»ÆĮæĪŖ0.8![]() £¬COµÄ×Ŗ»ÆĀŹĪŖ
£¬COµÄ×Ŗ»ÆĀŹĪŖ![]() 80% £¬ĪåŃõ»Æ¶žµāŗĶµā¶¼ŹĒ¹ĢĢ壬ĖłŅŌøĆ»Æѧ·“Ó¦µÄĘ½ŗā³£ŹżK= C5(CO2)/ C5(CO)”£
80% £¬ĪåŃõ»Æ¶žµāŗĶµā¶¼ŹĒ¹ĢĢ壬ĖłŅŌøĆ»Æѧ·“Ó¦µÄĘ½ŗā³£ŹżK= C5(CO2)/ C5(CO)”£
¢Ū·“Ó¦£ŗI2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)µÄ¦¤H<0”£
5CO2(g)+I2(s)µÄ¦¤H<0”£
¢ÜÉĻŹö·“Ó¦ŌŚT1ĻĀ“ļµ½Ę½ŗāŹ±£¬c(CO)=0.2mol/L£¬c(CO2)=0.8mol/L£¬K= C5(CO2)/ C5(CO)= ![]() ”£ŌŁĻņČŻĘ÷ÖŠ³äČėĪļÖŹµÄĮæ¾łĪŖ2 molµÄCOŗĶCO2ĘųĢ壬Qc=
”£ŌŁĻņČŻĘ÷ÖŠ³äČėĪļÖŹµÄĮæ¾łĪŖ2 molµÄCOŗĶCO2ĘųĢ壬Qc=![]() <K£¬Ōņ»ÆŃ§Ę½ŗāĻņÓŅŅĘ¶Æ”£
<K£¬Ōņ»ÆŃ§Ę½ŗāĻņÓŅŅĘ¶Æ”£
¢ŻŅņĪŖ·“Ó¦Ē°ŗóĘųĢå·Ö×ÓŹż²»±ä£¬ĖłŅŌČŻĘ÷ÄŚµÄŃ¹Ēæ²»·¢Éś±ä»Æ£»COŗĶCO2µÄ»Æѧ¼ĘĮæŹżŹĒĻąĶ¬µÄ£¬ĖłŅŌµ„Ī»Ź±¼äÄŚĻūŗÄCOŗĶÉś³ÉCO2µÄĪļÖŹµÄĮæÖ®±ČŹ¼ÖÕĪŖ1”Ć1”£Ź¼ÖÕ²»±äµÄŹż¾Ż²»ÄÜ×÷ĪŖĘ½ŗāדĢ¬µÄ±źÖ¾”£»ģŗĻĘųµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæŗĶ»ģŗĻĘųµÄĆܶȏĒ±äĮ棬ĖłŅŌæÉŅŌ±ķŹ¾ÉĻŹö·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ»ģŗĻĘųµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»ÆŗĶ»ģŗĻĘųµÄĆÜ¶Č²»ŌŁ±ä»Æ£¬ĢīBC”£
£Ø3£©¢ŁNa2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ¦¤H1=a kJ”¤mol1£¬¢ŚCl2(g)+H2O(l)
Na2SO4(aq)+2HCl(aq) ¦¤H1=a kJ”¤mol1£¬¢ŚCl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ¦¤H2=b kJ”¤mol1”£ÓÉ¢Ł-¢ŚµĆ£¬Na2SO3(aq) + HClO(aq)
HCl(aq)+HClO(aq) ¦¤H2=b kJ”¤mol1”£ÓÉ¢Ł-¢ŚµĆ£¬Na2SO3(aq) + HClO(aq) ![]() Na2SO4(aq) + 2HCl(aq)£¬ĖłŅŌ¦¤H=£Øa-b£©kJ”¤mol1£¬¼“
Na2SO4(aq) + 2HCl(aq)£¬ĖłŅŌ¦¤H=£Øa-b£©kJ”¤mol1£¬¼“![]() Na2SO4(aq) + 2HCl(aq) ¦¤H=£Øa-b£©kJ”¤mol1”£
Na2SO4(aq) + 2HCl(aq) ¦¤H=£Øa-b£©kJ”¤mol1”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĘū³µĪ²Ęų¾»»ÆµÄÖ÷ŅŖ·“Ó¦ŌĄķĪŖ2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)”£½«1.0 mol NO”¢0.8 mol CO³äČė2 LŗćČŻĆܱÕČŻĘ÷£¬·Ö±šŌŚT1”ęŗĶT2”ęĻĀ²āµĆn(CO2)Ėꏱ¼ä(t)µÄ±ä»ÆĒśĻßČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2CO2(g)+N2(g)”£½«1.0 mol NO”¢0.8 mol CO³äČė2 LŗćČŻĆܱÕČŻĘ÷£¬·Ö±šŌŚT1”ęŗĶT2”ęĻĀ²āµĆn(CO2)Ėꏱ¼ä(t)µÄ±ä»ÆĒśĻßČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
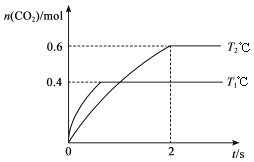
A. øĆ·“Ó¦ŹĒĪüČČ·“Ó¦
B. T1”ꏱ£¬K=0.9
C. T2”ꏱ£¬0~2sÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹv(N2)=0.075 mol/(L”¤s)
D. T1”ꏱ£¬ĻņĘ½ŗāĢåĻµÖŠ¼ÓČė1 mol NO£¬ŌŁ“ĪĘ½ŗāŹ±NO×Ŗ»ÆĀŹ“óÓŚ40%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ25”ꏱ£¬½«1.0Lw mol”¤L-lCH3COOHČÜŅŗÓė0.1molNaOH¹ĢĢå»ģŗĻ£¬³ä·Ö·“Ó¦”£Č»ŗóĻņ»ģŗĻŅŗÖŠ¼ÓČėCH3COOH»ņCH3COONa¹ĢĢå£ØŗöĀŌĢå»żŗĶĪĀ¶Č±ä»Æ£©£¬ŅżĘšČÜŅŗpHµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
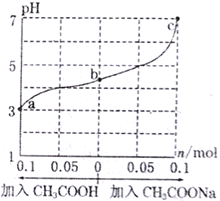
A. a”¢b”¢c¶ŌÓ¦µÄ»ģŗĻŅŗÖŠ£¬Ė®µÄµēĄė³Ģ¶ČÓɓ󵽊”µÄĖ³ŠņŹĒc>a>b
B. bµć»ģŗĻŅŗÖŠc(Na+)>c(CH3COO-)
C. ¼ÓČėCH3COOH¹ż³ĢÖŠ£¬![]() Ōö“ó
Ōö“ó
D. 25”ꏱ£¬CH3COOHµÄµēĄėĘ½ŗā³£ŹżKa=![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČ«·°ŅŗĮ÷µē³ŲŹĒŅ»ÖÖŠĀŠĶµÄĀĢÉ«»·±£“¢Äܵē³Ų£¬Ęäµē³Ų×Ü·“Ó¦ĪŖ£ŗV3++VO2++H2O ![]() VO2++2H++V2+ £® ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
VO2++2H++V2+ £® ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A.·ÅµēŹ±Õż¼«·“Ó¦ĪŖ£ŗVO2++2H++e©=VO2++H2O
B.·ÅµēŹ±Ćæ×ŖŅĘ2molµē×ÓŹ±£¬ĻūŗÄ1molŃõ»Æ¼Į
C.³äµē¹ż³ĢÖŠµē×ÓÓÉŃō¼«¾µ¼ĻßŅĘĻņŅõ¼«£¬ŌŁÓÉŅõ¼«¾µē½āÖŹČÜŅŗŅĘĻņŃō¼«
D.·Åµē¹ż³ĢÖŠ£¬H+ÓÉÕż¼«ŅĘĻņøŗ¼«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻŅŖĒó»Ų“šĪŹĢā£ŗ
£Ø1£©ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ ¢Ł2CH3OH£Øl£©+3O2£Øg£©ØT2CO2£Øg£©+4H2O£Øg£©”÷H=©1275.6kJmol©1
¢ŚH2O£Øl£©ØTH2O£Øg£©”÷H=+44.0kJmol©1
Š“³ö±ķŹ¾¼×“¼Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ £®
£Ø2£©ėĀ£ØH2NNH2£©ŹĒŅ»ÖÖøßÄÜČ¼ĮĻ£¬ÓŠ¹Ų»Æѧ·“Ó¦µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£®ŅŃÖŖ¶ĻĮŃ1mol»Æѧ¼üĖłŠčµÄÄÜĮæ£ØkJ£©£ŗN”ŌNĪŖ942”¢O=OĪŖ500”¢N©NĪŖ154£¬Ōņ¶ĻĮŃ1mol N©H¼üĖłŠčµÄÄÜĮæ£ØkJ£©ŹĒ £® 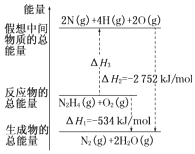
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æZrO2³£ÓĆ×÷ĢՓɲÄĮĻ£¬æÉÓÉļÆӢɰ(Ö÷ŅŖ³É·ÖĪŖZrSiO4£¬Ņ²æɱķŹ¾ĪŖZrO2”¤SiO2£¬»¹ŗ¬ÓŠÉŁĮæFe2O3”¢Al2O3”¢SiO2µČŌÓÖŹ)ĶعżČēĻĀ·½·ØÖĘČ””£

ŅŃÖŖ£ŗ¢ŁZrO2ÄÜÓėÉÕ¼ī·“Ӧɜ³ÉæÉČÜÓŚĖ®µÄNa2ZrO3£¬Na2ZrO3ÓėĖį·“Ӧɜ³ÉZrO2£«”£
¢Ś²æ·Ö½šŹōĄė×ÓŌŚŹµŃéĢõ¼žĻĀæŖŹ¼³ĮµķŗĶĶźČ«³ĮµķµÄpHČēĻĀ±ķĖłŹ¾”£
½šŹōĄė×Ó | Fe3£« | Al3£« | ZrO2£« |
æŖŹ¼³ĮµķŹ±pH | 1.9 | 3.3 | 6.2 |
³ĮµķĶźČ«Ź±pH | 3.2 | 5.2 | 8.0 |
(1)”°ČŪČŚ”±Ź±ZrSiO4·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ________________________________”£
(2)”°ĀĖŌü¢ń”±µÄ»ÆѧŹ½ĪŖ________________”£
(3)ĪŖŹ¹ĀĖŅŗ¢ńÖŠµÄŌÓÖŹĄė×Ó³ĮµķĶźČ«£¬ŠčÓĆ°±Ė®µ÷pH£½a£¬ŌņaµÄ·¶Ī§ŹĒ________£»¼ĢŠų¼Ó°±Ė®ÖĮpH£½bŹ±£¬Ėł·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________________________________”£
(4)Ļņ”°¹żĀĖ¢ó”±ĖłµĆĀĖŅŗÖŠ¼ÓČėCaCO3·ŪÄ©²¢¼ÓČČ£¬µĆµ½Į½ÖÖĘųĢ唣øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶŠæŌµē³Ų£ØČēĶ¼£©¹¤×÷Ź±£¬ŅŌĻĀĖµ·ØÕżČ·µÄŹĒ£Ø””””£© ¢Łµē×ÓĮ÷¶Æ·½Ļņ“ÓZn©µĘÅŻ©Cu©ŃĪĒÅ£»¢ŚZnµē¼«µÄÖŹĮæ¼õĒįCuµē¼«µÄÖŹĮæŌöÖŲ£»¢ŪŃĪĒÅÖŠµÄK+ŅĘĻņCuSO4ČÜŅŗ£»¢Ü½«Šæʬ½žČėĮņĖįĶČÜŅŗ·¢ÉśµÄ»Æѧ·“Ó¦ÓėøƵē³Ų·“Ó¦ĻąĶ¬ĪŖ£ŗZn+Cu2+ØTZn2++Cu£»¢ŻZnµē¼«Ź§µē×Ó·¢Éś»¹Ō·“Ó¦£®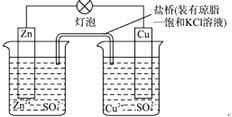
A.¢Ł¢Ś¢Ū
B.¢Ś¢Ü¢Ż
C.¢Ś¢Ū¢Ü
D.¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬ĻĀĮŠÓŠ¹ŲČÜŅŗÖŠĮ£×ÓµÄĪļÖŹµÄĮæÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ£Ø””””£©
A.0.1mol/LCH3COONaÓė0.1mol/LHClČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØNa+£©=c£ØCl©£©£¾c£ØOH©£©£¾cCH3COO©£©
B.0.1mol/LNH4ClÓė0.1mol/L°±Ė®µČĢå»ż»ģŗĻ£ØpH£¾7£©£ŗc£ØNH3H2O£©£¾c£ØNH4+£©£¾c£ØCl©£©£¾c£ØOH©£©
C.0.1mol/LNa2CO3Óė0.1mol/L NaHCO3ČÜŅŗµČĢå»ż»ģŗĻ£ŗ ![]() c£ØNa+£©=c£ØCO32©£©+c£ØHCO3©£©+c£ØH2CO3£©
c£ØNa+£©=c£ØCO32©£©+c£ØHCO3©£©+c£ØH2CO3£©
D.0.1mol/LNa2C2O4Óė0.1mol/LHClČÜŅŗµČĢå»ż»ģŗĻ£ØH2C2O4ĪŖ¶žŌŖČõĖį£©£ŗ2c£ØC2O42©£©+c£ØHC2O4©£©+c£ØOH©£©=c£ØNa+£©+c£ØH+£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒŅ»ÖÖĄūÓĆļ®µē³Ų”°¹Ģ¶ØCO2”±µÄµē»ÆѧװÖĆ£¬ŌŚ“߻ƼĮµÄ×÷ÓĆĻĀ£¬øƵē»ÆѧװÖĆ·ÅµēŹ±æɽ«CO2×Ŗ»ÆĪŖCŗĶLi2CO3£¬³äµēŹ±Ń”ÓĆŗĻŹŹ“߻ƼĮ£¬½öŹ¹Li2CO3·¢ÉśŃõ»Æ·“Ó¦ŹĶ·Å³öCO2ŗĶO2”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ

A. øƵē³Ų·ÅµēŹ±£¬Li+Ļņµē¼«X·½ĻņŅʶÆ
B. øƵē³Ų³äµēŹ±£¬µē¼«YÓėĶā½ÓÖ±Į÷µēŌ“µÄøŗ¼«ĻąĮ¬
C. øƵē³Ų·ÅµēŹ±£¬Ćæ×ŖŅĘ4 molµē×Ó£¬ĄķĀŪÉĻÉś³É1mol C
D. øƵē³Ų³äµēŹ±£¬Ńō¼«·“Ó¦Ź½ĪŖ£ŗC+2Li2CO3-4e-=3CO2”ü+4Li
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com