
下列各组离子浓度在指定溶液中一定能大量共存的是
①加入铝能放出H2的溶液中:Al3+、Fe2+、Cl-、N 、S2-
、S2-
②使pH=11的溶液中:Na+、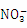 、
、 、
、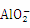 、S2-
、S2-
③由水电离出的c(H+)=10-12mol/L的溶液中:Na+、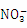 、
、 、
、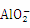 、S2-
、S2-
④能使淀粉碘化钾试纸显蓝色的溶液:K+、 、
、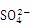 、S2-、OH-
、S2-、OH-
⑤使甲基橙变红的溶液中:Fe3+、 、Cl-、K+、
、Cl-、K+、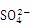
| A.③④ | B.②④ | C.②⑤ | D.①⑤ |
【答案】C
【解析】本题考查了离子共存问题。因加入Al能放出H2的溶液可能为酸或碱的溶液,若在碱溶液中,OH-离子与Fe2+、Al3+结合生成沉淀,若在酸溶液中,Fe2+、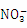 发生氧化还原反应,
发生氧化还原反应,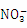 、S2-发生氧化还原反应,即该组离子一定不能大量共存,故①错。pH=11的溶液中存在大量的OH-,但该组离子在碱性条件下不发生反应,则能够大量共存,故②对。由水电离的c(H+)=10-12mol•L-1的溶液中水的电离受到抑制,可能为酸或碱的溶液,在酸性溶液中
、S2-发生氧化还原反应,即该组离子一定不能大量共存,故①错。pH=11的溶液中存在大量的OH-,但该组离子在碱性条件下不发生反应,则能够大量共存,故②对。由水电离的c(H+)=10-12mol•L-1的溶液中水的电离受到抑制,可能为酸或碱的溶液,在酸性溶液中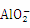 氢离子可结合为沉淀氢氧化铝,
氢离子可结合为沉淀氢氧化铝,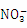 可与
可与 、S2-发生氧化还原反应,故③错。能使淀粉碘化钾试纸显蓝色的溶液具有氧化性,能与
、S2-发生氧化还原反应,故③错。能使淀粉碘化钾试纸显蓝色的溶液具有氧化性,能与 、S2-发生氧化还原反应,故④错。使甲基橙变红的溶液,pH<3.1,溶液显酸性,该组离子之间不反应,能共存,故⑤对。故该题选C。
、S2-发生氧化还原反应,故④错。使甲基橙变红的溶液,pH<3.1,溶液显酸性,该组离子之间不反应,能共存,故⑤对。故该题选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如图是关于反应A2(g)+3B2(g)⇌2C(g)△H<0的平衡移动图形,影响平衡移动的原因是( )

|
| A. | 升高温度,同时加压 |
|
| B. | 降低温度,同时减压 |
|
| C. | 增大反应物浓度,同时减小生成物浓度 |
|
| D. | 增大反应物浓度,同时使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在 (填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol•L﹣1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)根据你所选择的指示剂,正确判断滴定终点的现象是: .
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol•L﹣1,烧碱样品的纯度是 97.56% .
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 |
|
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生的后果.(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 .
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )

|
| A. | 图a为碱式滴定管,可盛装NaOH、KMnO4等溶液,不可盛装酸性液体 |
|
| B. | 图b中曲线表示反应2A(g)+B(g)⇌2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 |
|
| C. | 图c表示铜的精炼,则X是精铜,Y是粗铜,Z是CuSO4溶液 |
|
| D. | 图d表示25℃时,CaSO4在水中的沉淀溶解平衡曲线.向100 mL该条件下的CaSO4饱和溶液中加入100 mL 0.01mol•L﹣1的Na2SO4溶液有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)肼燃料电池原理如图1所示,左边电极上发生的电极反应式为 .

(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJ•mol﹣1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJ•mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣52.7kJ•mol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: .
(3)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
①B中可通过 判断可逆反应2NO2⇌N2O4已经达到平衡.
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药。
(1)Ni2+基态核外电子排布式为 。
(2)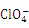 的空间构型是 ;与
的空间构型是 ;与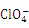 互为等电子体的一种分子为 (填化学式)。
互为等电子体的一种分子为 (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为 ;1molCO(N2H3)2分子中含有σ键数目为 。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a∶b∶c= 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确的是
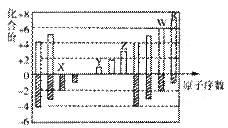
| A.原子半径比较: | B.气态氢化物的还原性比较:W>R |
| C.WX3和水反应形成的化合物是离子化合物 | D.含Z元素的盐溶液一定显示酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
|
| A. | a mL | B. | (50﹣a)mL | C. | 大于(50﹣a)mL | D. | 大于a mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
将﹣CH3、﹣OH、﹣COOH、﹣CHO、﹣ 五种原子团两两结合,所得有机化合物水溶液呈酸性的共( )
五种原子团两两结合,所得有机化合物水溶液呈酸性的共( )
|
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com