
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
 ,X是氮元素,它的气态氢化物的电子式为
,X是氮元素,它的气态氢化物的电子式为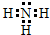 ,电子层结构相同时,核电荷数越多,离子半径越小,所以半径:Na+>Al3+,故答案为:
,电子层结构相同时,核电荷数越多,离子半径越小,所以半径:Na+>Al3+,故答案为: ;
;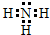 ;>;
;>;

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| Q1 |
| 2 |
| Q1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 链状结构的同分异构体最多有
链状结构的同分异构体最多有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com