
某恒温密闭容器中,可逆反应A(s)B+C(g) ΔH=Q kJ/mol (Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗∶n(C)消耗=1∶1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
过氧乙酸是在抗SARS病毒期间常使用的一种高效杀毒剂,其分子式为C2H4O3,它具有氧化性,漂白作用,下列物质中漂白作用原理与过氧乙酸不同的是( )
A.氯水(次氯酸) B.臭氧 C.活性炭 D.过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
测得某金属冶炼厂的酸性工业废水中,含有一定量的Fe3+、Cu2+、Au3+等离子。按照“变废为宝”的原则,设计了下图中的回收流程,要求利用常见的酸、碱和工业生产中的废铁屑,从该工业废水中回收金、并生产化工原料铁红和氧化铜。

请你完成下面的问题:
(1)流程图中标号处需加入的相应物质分别是:① ;② ;
③ ;⑤ 。
(2)写出流程图中①处有气体生成的离子方程式: 。
(3)写出流程图中③处发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
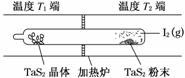
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________________________。
(4)25℃时,H2SO3HSO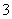 +H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中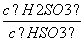 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=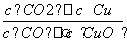
B.反应③的平衡常数K=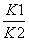
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:___________________________
________________________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_________________________________________________________________
________________________________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO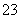 )∶n(HSO
)∶n(HSO )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO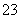 )+c(HSO
)+c(HSO )
)
b.c(Na+)>c(HSO )>c(SO
)>c(SO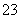 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO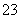 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(4)(201 2·福建高考节选)能证明Na2SO3溶液中存在SO
2·福建高考节选)能证明Na2SO3溶液中存在SO +H2OHSO
+H2OHSO +OH-水解平衡的事实是________(填序号)。
+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红 ,再加入H2SO4溶液后红色褪去
,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
将某溶液逐滴加入到氢氧化铁胶体中,开始产生沉淀,后又溶解的是( )
A.2 mol·L-1的氢氧化钠溶液 B.2 mol·L-1的硫酸溶液
C.2 mol·L-1的硫酸镁溶液 D.2 mol·L-1的乙醇溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com