
某小组取一定质量的FeSO4固体,利用下图装置进行实验。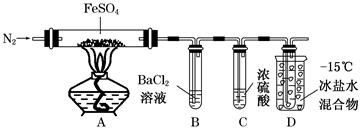
| 实验 | 实验过程 | 实现现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:实验题
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在呼吸面具和潜水艇中可用Na2O2作为供氧剂,请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明Na2O2可作供氧剂。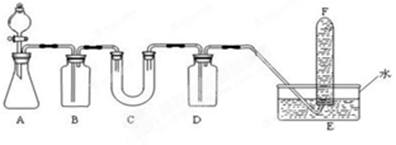
(1)A是制取CO2的装置。在实验室里,CO2常用稀盐酸与石灰石反应来制取,反应的化学方程式为: 。(2分)
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | (2分) |
| C | Na2O2 | (2分) |
| D | NaOH溶液 | (2分) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴 试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是 。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
| A.蒸发皿 | B.石棉网 | C.烧杯 | D.玻璃棒 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。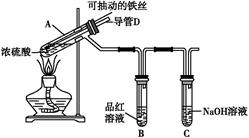
(1)实验过程中,观察到B中的实验现象是 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是 ;
反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2: ;
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作步骤、实验现象及结论。限选试剂:酸性KMnO4溶液、NaOH溶液、淀粉KI溶液、KSCN溶液。
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 _;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下: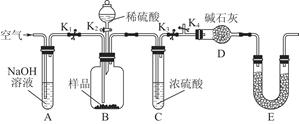
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _ 、洗涤、干燥;
②装置E中药品的名称是 __作用为 __;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 ;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 _,关闭的是 _。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 _
若假设三成立,则Cu(OH)2的质量分数为 _;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题:
(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化钠能与二氧化碳反应,在“神七”的航天舱中、在宇航员太空漫步时穿的航天服中、在潜艇中均使用过氧化钠作制氧剂,供人呼吸之用。某学生选用大理石、盐酸和一定量过氧化钠药品设计实验,验证这一事实。
请根据所给装置回答下列问题: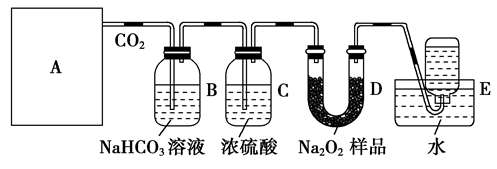
(1)A是制取CO2的装置,最好选用下列装置中的________(填序号)。
(2)B装置中发生的离子方程式是_____________________________________________。
C装置的作用是_____________________________________________________。
(3)D装置中发生反应的化学方程式是______________________________________。
(4)要想得到较纯净的氧气,可在装置D和E之间增加一盛有__ ______(填写试剂名称)的________(填写装置名称)。
(5)如何检验集气瓶中收集到的气体_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com