
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸有氧化性,稀硫酸无氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
分析 A.浓硫酸具有脱水性,使蔗糖炭化;
B.稀硫酸溶液中氢离子具有氧化性;
C.浓硫酸能和氨气发生反应生成硫酸铵;
D.浓硫酸密度大于水,浓硫酸稀释时,将浓硫酸倒入水中并不断搅拌
解答 解:A.浓硫酸具有脱水性,使蔗糖中H、O元素以水的形式脱出,则炭化变黑,与吸水性无关,故A错误;
B.稀硫酸也具有氧化性,由氢离子表现出,故B错误;
C.浓硫酸具有吸水性,可用于不与硫酸反应的气体干燥剂,氨气和硫酸发生反应生成硫酸铵,不能干燥氨气,故C错误;
D.浓硫酸稀释时,将浓硫酸倒入水中并不断搅拌,防止浓硫酸稀释过程中放出的热量使局部受热而溅出液体,产生安全事故,故D正确;
故选D.
点评 本题考查浓硫酸的性质,注意浓硫酸的特性与应用,把握浓硫酸与稀硫酸的性质的异同,本题侧重于基础知识的考查,注意相关知识的学习与积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
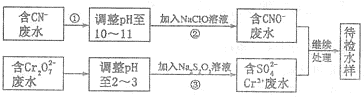
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜片放入浓HNO3溶液中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的实验式 C3H6 | |
| B. | 镁离子的结构示意图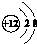 | |
| C. | CO2的电子式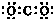 | |
| D. | 中子数为18的氯原子符号${\;}_{17}^{18}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
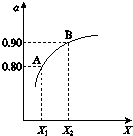
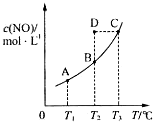 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com