
| A. | 0.05mol/L | B. | 0.03mol/L | C. | 0.3mol/L | D. | 0.04mol/L |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤⑥ | C. | ①②④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘两边各垫一张质量相等的纸片称取固体NaOH | |
| B. | 容量瓶内水分未干便注入了液体 | |
| C. | 洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶 | |
| D. | 定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
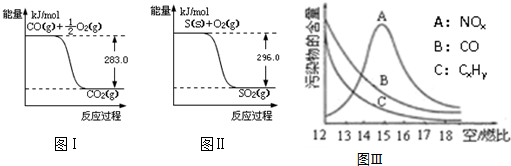
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com