
| A. | 配制一定物质的量浓度溶液中,洗净的容量瓶要放进烘箱中烘干,以防溶液被稀释 | |
| B. | 测量Zn与稀硫酸反应速率的实验中,应在标准状况下测量H2的体积,以方便计算 | |
| C. | 酸碱滴定实验中,用待测溶液润洗锥形瓶,以减少实验误差 | |
| D. | 中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分 |
分析 A.容量瓶不需要烘干;
B.测定速率,需要测定时间与气体体积变化;
C.酸碱滴定实验中,锥形瓶不需要润洗;
D.中和热的测定实验中,要用环形玻璃搅拌棒搅拌,测定最高温度.
解答 解:A.容量瓶不需要烘干,有少量水对实验无影响,最后需要加水定容,故A错误;
B.测定速率,需要测定时间与气体体积变化,不需要控制标准状况下,故B错误;
C.酸碱滴定实验中,锥形瓶不需要润洗,若用待测溶液润洗锥形瓶,测定结果偏大,故C错误;
D.中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分,测定最高温度,操作合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、中和滴定、中和热测定为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
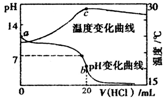
| A. | a点由水电离出的c(H+)<1.0×10-14mol•L-1 | |
| B. | b点时存在c(NH4+)+c(NH3•H2O)=c(C1-) | |
| C. | c点以后溶液温度下降的原因是盐酸的持续加入 | |
| D. | 在整个过程中可能会出现的离子浓度关系:c(NH4+)=c(C1-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
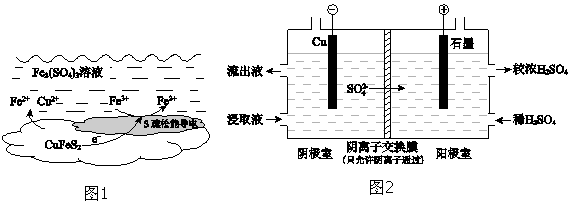
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| C. | 烈性炸药硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 | |
| D. | 蚊虫叮咬时释放出的蚁酸使人觉得不适,可以用肥皂水氧化蚁酸处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62(a+b)g | B. | 186(a+b)g | C. | (cV-$\frac{a+b}{3}$)mol | D. | (cV-$\frac{9a+b}{3}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比 12C 多两个质子 | B. | 与 12C 化学性质相似 | ||
| C. | 与 12C 互为同素异形体 | D. | 质子数与中子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体,则$\frac{c(C{H}_{3}CO{O}^{-})}{C(N{a}^{+})}$ 增大 | |
| B. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$ 的值及SO2转化率不变 | |
| C. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | lmol该化合物( 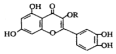 )与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol )与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com