
| A. | 过氧化钠与水反应,若电子转移4NA,则产生的氧气为32g | |
| B. | 标准状况下,22.4L空气中含有NA个分子 | |
| C. | 4g乙烯与丙烯的混合气体含有0.15NA个碳原子 | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
分析 A.过氧化钠中氧元素的化合价为-1价,过氧化钠与水反应生成1mol氧气转移2mol电子;
B.标准状况下1mol任何气体的体积约为22.4L;
C.乙烯和丙烯的最简式均为CH2;
D.铜只能与浓硫酸反应,与稀硫酸不反应.
解答 解:A.过氧化钠与水反应,转移的电子为2mol,则生成氧气的物质的量为1mol,若电子转移4NA,产生的氧气物质的量为2mol,氧气的质量为64g,故A错误;
B.标准状况下,22.4L空气中含有分子数=$\frac{22.4L}{22.4L/mol}$×NA=NA个,故B正确;
C.乙烯和丙烯的最简式均为CH2,故1.4g混合物中含有的CH2的物质的量为1.4÷14=0.1mol,故含0.1NA个碳原子,故C错误;
D.铜只能与浓硫酸反应,与稀硫酸不反应,故硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积的条件应用、氧化还原反应电子转移的分析和浓硫酸变为稀硫酸不与铜继续反应、微粒数的计算应用,掌握基础是解题关键,题目难度中等.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH4与4 mol Cl2在光照下反应可生成1 mol CCl4 | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 现有乙烯、丙烯的混合气体共14g,其原子数为3NA | |
| D. | 1 mol乙烷和丙烷的混合物,完全燃烧生成3 mol H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰晶石的化学式:Na3AlF6 | |
| B. | 羟基的电子式: | |
| C. | 磷酸的电离方程式:H3PO4?3H++PO43- | |
| D. | 聚丙烯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
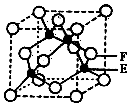 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有规则几何外形的固体一定是晶体 | |
| B. | 晶体与非晶体的根本区别在于是否具有规则的几何外形 | |
| C. | 晶体、非晶体具有固定的熔点 | |
| D. | 具有各向异性的固体一定是晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com