
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
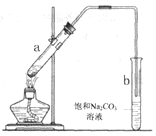
A. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
B. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
C. 试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
科目:高中化学 来源: 题型:
【题目】金属材料在日常生产生活中有着广泛的应用,请回答下列问题:
(1)人类最早使用的合金是___________,目前使用量最大的金属是________。
(2)铁和铁合金是日常生活中的常用材料,下列叙述正确的是________。
A.纯铁的硬度比生铁高 B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中会钝化
(3)向沸水中滴入几滴饱和FeCl3溶液,加热至液体呈透明的红褐色,该反应的离子方程式为__________,形成的分散系中分散质的微粒直径范围是_________。
(4)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3∶1,请写出发生的离子反应方程式___________________。
(5)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:_________________,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是___________,可能含有的离子是_________。如果从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水。需要用到的一组试剂是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高铁酸钠(Na2FeO4)是一种新型净水剂。高铁酸钠的制备方法之一是:在碱性条件下用NaClO氧化Fe3+,请写出该反应的离子反应方程式______________。
(7)有一种铁的氧化物样品,用5 mol/L盐酸140 mL,恰好完全溶解,所得溶液还能吸收标况下0.56 L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组的同学对一粗盐样品进行初步提纯。所用实验仪器或用品如下:

(1)D的名称是______________。
(2)提纯的步骤是:溶解、过滤、_____________。
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中的“二低”是_______________、__________________。
(4)该实验中多次利用仪器B和仪器_____________(填字母序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如图:

在阳极区发生的反应包括 和H ++ ![]()
![]() H2O + CO2↑。简述
H2O + CO2↑。简述![]() 在阴极区再生的原理 。
在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃,101 kPa下:H2(g) +![]() O2(g)
O2(g) ![]() H2O(g) Δ H1= 242 kJ/mol
H2O(g) Δ H1= 242 kJ/mol
CH3OH(g) +![]() O2(g)
O2(g) ![]() CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。

(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示,下列说法正确的是 。

A.p1> p2> p3>p4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1> T2> T3>T4
D.T4、p4时,H2的平衡转化率为60%
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
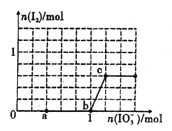
A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池等方面,NO2的二聚体N2O4是火箭中常用的氧化剂。请回答下列问题:

(1)肼燃料电池的原理如图1所示,左边电极上发生反应的电极反应式为 。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
① N2(g)+2O2(g)![]() 2NO2(g) ΔH1=67.7 kJ·mol1;
2NO2(g) ΔH1=67.7 kJ·mol1;
② N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=534.0 kJ·mol1;
N2(g)+2H2O(g) ΔH2=534.0 kJ·mol1;
③2NO2(g)![]() N2O4(g) ΔH3=52.7 kJ·mol1。
N2O4(g) ΔH3=52.7 kJ·mol1。
气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式为 。
(3)联氨在工业生产中常以氨和次氯酸钠为原料获得,也可在高锰酸钾作催化剂条件下,用尿素[CO(NH2)2]和次氯酸钠、氢氧化钠溶液反应获得,尿素法反应的离子方程式为 。
(4)某模拟“人工树叶”的电化学实验装置如图2所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。该装置工作时,H+从 (填字母,后同)极区向 极区迁移,将电能转化为 能,每生成1 mol O2,有 g CO2被还原(小数点后保留1位数字)。
(5)图3中甲装置为C3H8O的燃料电池(电解质溶液为KOH溶液)装置,该同学想在乙装置中实现铁上镀铜,则f处通 ,写出电极c上的电极反应式: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如下图所示。下列说法不正确的是

A. 阳极室溶液由无色变成浅绿色
B. 当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成
C. 电解时中间室(NH4)2SO4溶液浓度下降
D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为 ,请回答下列问题。
,请回答下列问题。
(1)A中所含官能团的名称是___________、___________;
(2)A可能发生的反应有___________(填序号);
①水解反应 ②消去反应 ③加成反应 ④酯化反应
将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com