【答案】
分析:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s
22p
3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s
22s
1或1s
22s
22p
2,结合(3)能与N元素形成阴离子(AN
-),故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,据此解答.
解答:解:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s
22p
3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s
22s
1或1s
22s
22p
2,结合(3)能与N元素形成阴离子(AN
-),故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,
(1)C、N、S元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(2)H
2CO
3中C原子最外层电子数全部成键,没有孤电子对,成1个C=O双键,2个C-O单键,杂化轨道数目为3,采取sp
2杂化,故答案为:sp
2;
(3)将CN
-中C原子及1个负电荷换成1个N原子,可得的等电子体N
2,将N原子及1个负电荷换成1个O原子,可得的等电子体CO,故答案为:N
2、CO;
(4)D的原子序数是29,为Cu元素,其原子核外电子排布式为:1s
22s
22p
63s
23p
63d
104s
1,
由晶胞结构可知,Ca原子处于顶点,晶胞中含有Ca原子数目为8×

=1,Cu原子处于晶胞内部与面上、面心,晶胞中Cu数目为1+4×

+4×

=5,故该合金中Ca和Cu的原子个数比为1:5,
故答案为:1s
22s
22p
63s
23p
63d
104s
1,1:5;
(5)将氨水滴加到硫酸铜溶液中,首先反应生成氢氧化铜沉淀,继续滴加氨水,氢氧化铜与氨水反应生成四氨合铜络离子,反应的离子方程式为:Cu(OH)
2+4NH
3?H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O,
故答案为:Cu(OH)
2+4NH
3?H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O.
点评:本题以元素的推断考查了原子的杂化方式、核外电子排布规律、电离能、晶胞计算、配合物等知识点,注意同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA和第IIIA族、第VA族和第VIA族之间异常,为易错点.

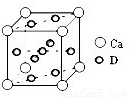
 =1,Cu原子处于晶胞内部与面上、面心,晶胞中Cu数目为1+4×
=1,Cu原子处于晶胞内部与面上、面心,晶胞中Cu数目为1+4× +4×
+4× =5,故该合金中Ca和Cu的原子个数比为1:5,
=5,故该合金中Ca和Cu的原子个数比为1:5,

 名校课堂系列答案
名校课堂系列答案
 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】 【化学-物质结构与性质】
【化学-物质结构与性质】