
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
分析 A.使酚酞呈红色的溶液,显碱性;
B.加水稀释pH减小的溶液,显碱性;
C.离子之间发生氧化还原反应;
D.c(OH-)<$\sqrt{{K}_{w}}$的溶液,显酸性.
解答 解:A.使酚酞呈红色的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.加水稀释pH减小的溶液,显碱性,碱溶液中不能大量存在Al3+,故B错误;
C.H+、NO3-、I-(或Fe2+)发生氧化还原反应,不能大量共存,故C错误;
D.c(OH-)<$\sqrt{{K}_{w}}$的溶液,显酸性,不能大量存在ClO-,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
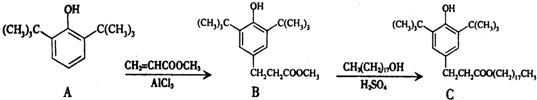
| A. | 物质A是苯甲醇的同系物 | |
| B. | 物质B能发生取代、加聚等反应 | |
| C. | 可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质 | |
| D. | 1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
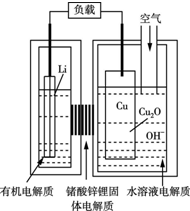 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )| A. | 放电时,电子通过固体电解质向Cu极移动 | |
| B. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e─=2Cu+2OH─ | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
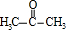 +2
+2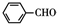 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$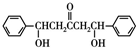 .
.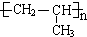 .
.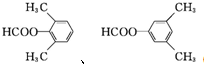 .
.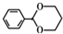 (无机物任选).
(无机物任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
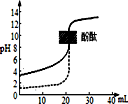
| A. | 反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 | |
| B. | 在铜的电解精炼过程中,若转移1mol电子,则阳极溶解32gCu | |
| C. | 常温下向CuS的悬浊液中加入饱和MnSO4溶液可生成MnS沉淀,则Ksp(MnS))<Ksp(CuS) | |
| D. | 常温下用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线(如图)表示的是滴定盐酸的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
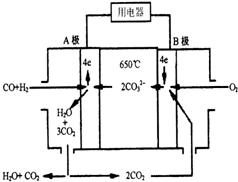 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>③>② | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数 | |
| D. | 向20mL氨水中加入10mL等浓度的盐酸,有c(NH4+)-c(NH3•H2O)=2[c(OH-)-c(H+)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
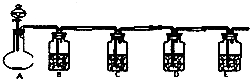 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com