
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气),30 s后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO(气)+6H2O(气),30 s后,NO的物质的量增加了0.3 mol,则此反应的平均速率![]() 为( )
为( )
A.v(O2)=0.01 mol·(L·s)-1 B.v(NO)=0.008 mol·(L·s)-1
C.v(H2O)=0.003 mol·(L·s)-1 D.v(NH3)=0.004 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省临沭一中高二12月学情调查化学试卷(带解析) 题型:单选题
现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是( )
| A.pH由小到大的顺序是①< ②< ③< ④ |
| B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③ |
| C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③ |
| D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学试卷(平行班)(解析版) 题型:选择题
在25℃时,用蒸馏水稀释1 mol·L-1氨水至0.01 mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是

查看答案和解析>>
科目:高中化学 来源:2013届广东省汕头市高二12月月考化学试卷 题型:填空题
(15分) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入 可抑制其水解
A NaOH固体 B 氯化铁固体 C 水 D 碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源:2010年高考化学试题分项专题七化学反应中的能量变化 题型:选择题
下列各表述与示意图一致的是
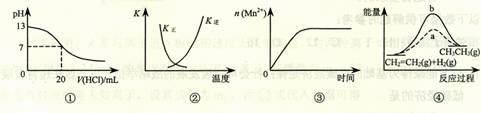
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)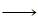 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com