
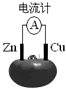
| A. | 铜电极上发生还原反应 | |
| B. | 电池工作时,铜电极附近会出现蓝色 | |
| C. | 锌片失去的电子通过番茄汁流向铜电极 | |
| D. | 工作一段时间后,两极质量均减轻 |
分析 锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,电子由负极流出,经过导线流向正极,以此解答.
解答 解:A.由于锌比铜活泼,则锌为负极,铜为正极,正极发生还原反应,故A正确;
B.铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,有气体生成,铜电极附近不会出现蓝色,故B错误;
C.锌为负极,铜为正极,电子由锌极流出,经过导线流向铜极,故C错误;
D.锌为负极,发生氧化反应,电极方程式为:Zn-2e-=Zn2+,Zn溶解而质量减轻,铜为正极,电极方程式为2H++2e-=H2↑,Cu极质量不变,故D错误,
故选A.
点评 本题考查原电池知识,侧重于学生的分析能力与知识迁移运用能力的考查,难度不大,注意把握原电池的构成条件和工作原理.


科目:高中化学 来源: 题型:多选题
| A. | 用溴水可以鉴别苯、苯酚、己烷、己烯 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物相同 | |
| D. | 分子式为C2H4和C4H8的物质一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯含有NA个苯分子 | |
| B. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| C. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| D. | 4g氦气所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3CH3和Cl2 | B. | CH2=CH2和HCl | C. | CH2=CH2和Cl2 | D. | CH3CH3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 溴苯?(溴) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
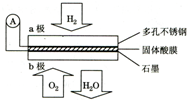
| A. | a极为负极,工作过程中a极附近酸性增强 | |
| B. | 电池总反应可表示为:2H2+O2=2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1mol电子,消耗标准状况下2.24L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
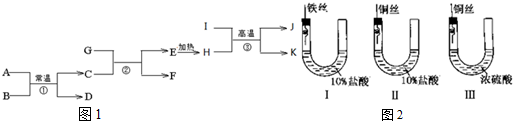
 ,F的电子式为
,F的电子式为 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1Ca(NO3)2溶液中:Na+、N${{H}_{4}}^{+}$、C${{O}_{3}}^{2-}$、CH3COO- | |
| B. | 能使甲基橙变红的溶液中:K+、Na+、N${{O}_{3}}^{-}$、Cl- | |
| C. | 3%H2O2溶液中:Fe2+、H+、S${{O}_{4}}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1KSCN溶液中:Fe3+、N${{H}_{4}}^{+}$、Br-、S${{O}_{4}}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
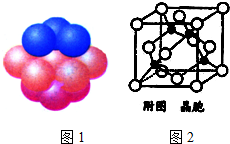 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com