
| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→还原 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中通入CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| B. | 向Na2SO3溶液通入SO2:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 向CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| D. | 向NH4Cl溶液中通入NH3:c(NH4+)<c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 | |
| B. | 不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 | |
| C. | 用托盘天平称量物品质量时,物品应置于右盘 | |
| D. | 实验时应节约药品,实验剩余的药品应放回原试剂瓶 | |
| E. | 可燃性气体点燃前一定要验纯 | |
| F. | 可燃性气体点燃前一定要验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
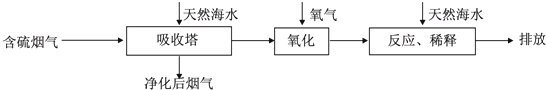
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com