
| 8.96L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
| B、pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
| C、0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率 |
| D、pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、油脂、蛋白质都能发生水解反应 |
| B、淀粉水解的最终产物能发生银镜反应 |
| C、蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
| D、脂肪能发生皂化反应,生成甘油和高级脂肪酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置是碳酸钠和碳酸氢钠的热稳定性的比较试验,回答下列问题
如图所示装置是碳酸钠和碳酸氢钠的热稳定性的比较试验,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
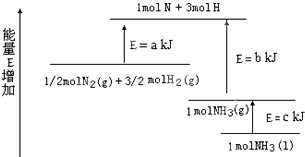
查看答案和解析>>
科目:高中化学 来源: 题型:
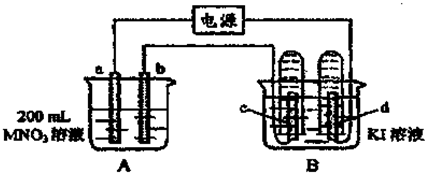
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com