
【题目】某无色溶液![]() 中,可能含有
中,可能含有![]() 中的一种或几种。现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示。下列说法中不正确的是( )
中的一种或几种。现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示。下列说法中不正确的是( )
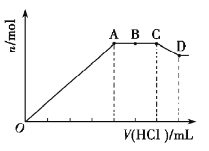
A.溶液![]() 中一定不含
中一定不含![]() ,可能含有
,可能含有![]()
B.![]() 段参加反应的阴离子的物质的量之比为
段参加反应的阴离子的物质的量之比为![]() 或
或![]()
C.![]() 段一定生成了气态物质
段一定生成了气态物质
D.![]() 段发生反应的离子方程式为:
段发生反应的离子方程式为:![]()
【答案】B
【解析】
溶液X是无色溶液,Cu2+在溶液中显蓝色,则原溶液中一定没有Cu2+,根据图像可知,AC段没有沉淀生成和消耗,说明AC段发生反应CO32-+2H+=CO2↑+H2O,该反应分为两个阶段进行,在AB段碳酸根离子恰好转化为碳酸氢根,BC段的反应为HCO3-+H+=CO2↑+H2O,根据离子共存原则,原溶液中一定不存在Mg2+、Al3+,CD段沉淀减少,发生反应Al(OH)3+3H+=Al3++3H2O,说明原溶液中一定含有AlO2-,但沉淀不完全消失,说明含有SiO32-,根据溶液呈电中性的原则可知原溶液一定含有Na+,可能含有Cl-。
A. 根据上述分析,溶液X中一定不含![]() ,可能含有
,可能含有![]() ,故A正确;
,故A正确;
B. CD段发生反应Al(OH)3+3H+=Al3++3H2O,假设盐酸浓度为1mol·L-1,与Al(OH)3反应的盐酸体积是1L,n(A1O2-)=![]() mol, OA段发生的反应为,2H++SiO32-=H2SiO3↓,AlO2-+H++H2O=Al(OH)3↓,推出n(SiO32-)=
mol, OA段发生的反应为,2H++SiO32-=H2SiO3↓,AlO2-+H++H2O=Al(OH)3↓,推出n(SiO32-)= mol,因此n(SiO32-):n(A1O2-)=11:2,故B错误;
mol,因此n(SiO32-):n(A1O2-)=11:2,故B错误;
C. 根据上述推断,BC段反应为HCO3-+H+=CO2↑+H2O,一定生成了气体,故C正确;
D. 根据上述推断,CD段发生反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
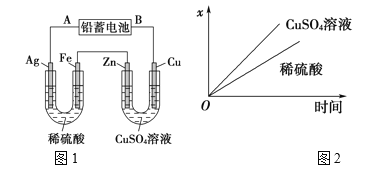
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:______。
(2)Ag电极的电极反应式是______,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度_______(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示_______。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶解氧(指溶解在水体中氧气分子)是衡量水质的一个重要指标。为测定某水样中溶解氧含量(ρ=![]() )设计了如下实验方案。实验步骤如下:
)设计了如下实验方案。实验步骤如下:
步骤1:水样的采集与固定
用水样瓶准确量取100mL的待测水样(不能留有气泡),并用针筒向水样下方快速注入2.0mLMnSO4溶液和3.0mL碱性KI溶液,盖好瓶盖,上下颠倒摇匀,此时生成Mn2+在碱性条件下被水中的氧气氧化为MnOOH棕色沉淀,静置至澄清。
步骤2:碘的游离
向水样瓶中加入3.0mL浓硫酸,使I-在酸性条件下被MnOOH氧化为I2,同时MnOOH被还原Mn2+,待沉淀完全溶解后,将它们全部转移到250mL锥形瓶中。
步骤3:碘的滴定
向锥形瓶中加入少量淀粉溶液,再滴加0.005mol·L-1的Na2S2O3标准溶液,恰好完全反应时,消耗Na2S2O3标准溶液的体积为16mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)MnOOH中Mn元素的化合价是___。
(2)写出步骤2中所发生反应的离子方程式___。
(3)若待测水样中留有气泡,则测定结果将___。(填“偏大”、“偏小”或“无影响”)
(4)计算该水样中溶解氧的含量ρ(以mg·L-1表示),并写出计算过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。
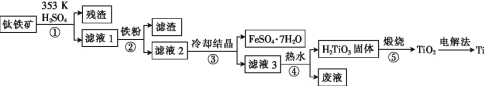
(1)步骤②、③、④中,均需进行的操作是____(填操作名称)。
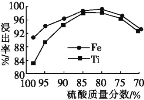
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为____,硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为____(填范围)。
(3)请结合离子方程式解释步骤④中加热水的原因:____。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在___(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态Co2+的核外电子排布式为____。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1 mol Fe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
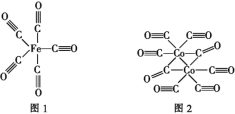
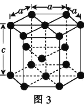
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为a nm,高为c nm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )
A.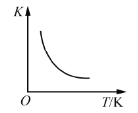 ,反应
,反应![]() 的平衡常数与温度的关系,说明该反应的
的平衡常数与温度的关系,说明该反应的![]()
B.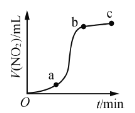 ,
,![]() 与过量浓硝酸反应生成的
与过量浓硝酸反应生成的![]() 气体体积随时间的变化关系,说明该反应在b→c时间段内反应速率最快
气体体积随时间的变化关系,说明该反应在b→c时间段内反应速率最快
C.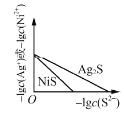 ,常温下
,常温下![]() 和
和![]() 的沉淀溶解平衡曲线,若
的沉淀溶解平衡曲线,若![]() 时,两者的
时,两者的![]() 相等
相等
D.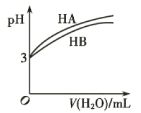 ,常温下
,常温下![]() 的
的![]() 和
和![]() 溶液分别加水稀释时
溶液分别加水稀释时![]() 的变化曲线,说明两者的电离平衡常数
的变化曲线,说明两者的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 的原子序数依次增大,其中
的原子序数依次增大,其中![]() 位于同一主族。
位于同一主族。![]() 的气态氢化物常用作制冷剂。
的气态氢化物常用作制冷剂。![]() 与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
A.最简单氢化物的沸点:![]()
B.原子半径:![]()
C.把![]() 通入石蕊试液中,石蕊先变红后褪色
通入石蕊试液中,石蕊先变红后褪色
D.向![]() 与水反应后的溶液中滴加
与水反应后的溶液中滴加![]() 溶液有白色沉淀生成
溶液有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A.1 L0.1 mol·L-1NaClO溶液中,阳离子数目为0.1NA
B.1molFe与32gS充分反应,转移的电子数目为2NA
C.1.12 L由NO2和CO2组成的混合气体中含氧原子数目为0.1NA
D.1molN2与足量的H2充分反应,生成N—H键的数目为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com